Международный эндокринологический журнал 2 (34) 2011
Вернуться к номеру
Место препаратов сульфонилмочевины в терапии сахарного диабета 2-го типа
Авторы: Каминский А.В., к.м.н., ГУ «Научный центр радиационной медицины НАМН Украины», г. Киев
Рубрики: Эндокринология
Версия для печати
На протяжении последних нескольких лет произошел глобальный пересмотр отношения к сахарному диабету (СД) 2-го типа. Оказалось, что этот тип диабета, которым болеет около 80 % пациентов, сопровождается развитием макроваскулярных осложнений, формирующихся за 5–10 лет до выявления гипергликемии (манифестации заболевания). Поэтому при первичной диагностике стойкой гипергликемии обнаруживают большую часть осложнений СД.
С точки зрения патофизиологии для СД 2-го типа характерным является наличие нескольких важных нарушений, приводящих к развитию гипергликемии: клеточной инсулинорезистености, избыточной выработки глюкозы печенью (в ночное время суток из липидов) и дефектов секреции инсулина. Последнее нарушение имеет двойственную природу: избыточная базальная (тощаковая) секреция инсулина и недостаточный стимулированный выброс инсулина после приема пищи (глюкоза, аминокислоты и др.). Поэтому наличие нескольких нарушений требует применения у больных СД 2-го типа комбинированной сахароснижающей терапии несколькими препаратами. Иные подходы применяются для лечения больных с СД 1-го типа и другими специфическими типами диабета, при которых отмечается абсолютный дефицит инсулина: использование заместительной гормональной терапии препаратами инсулина (интенсивная, базально-болюсная схема).
Современный врач стоит перед дилеммой: какой препарат назначить пациенту, тем более когда в арсенале имеется большой выбор схожих по действию препаратов? Однако такая «схожесть» имеется только на первый взгляд. Одни препараты используются уже многие годы, их применение вошло в привычку, они стоят недорого, хотя пациенту и приходится принимать их по 2–3 раза в день. Другие препараты стоят дороже, но действуют 24 часа, и поэтому принимать их надо всего 1 раз в день. То есть, несмотря на кажущуюся на первый взгляд дороговизну, препараты для однократного приема являются с фармакоэкономической точки зрения более выгодными — экономия за счет более стойкого сахароснижающего эффекта, меньших рисков развития ближайших и отдаленных осложнений.
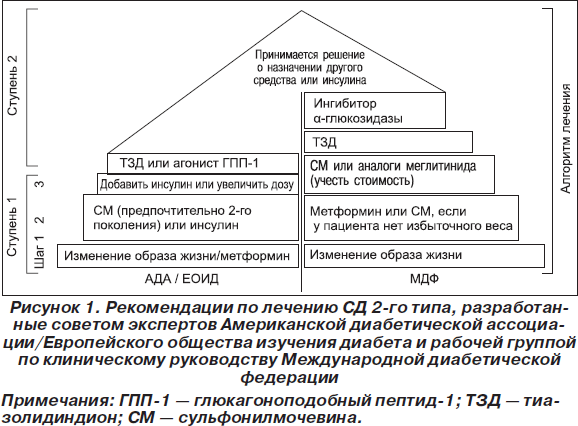
В глобальном руководстве по лечению СД 2-го типа, которым является консенсус между Американской диабетической ассоциацией (АДА) и Европейской ассоциацией изучения диабета (ЕАИД, 2006–2009 гг.) [1, 2], и новых Американских стандартах (АДА, 2011; Американская ассоциация клинических эндокринологов, апрель 2011) содержатся схожие принципы. Базовыми препаратами для лечения СД 2-го типа остаются метформин, препараты сульфонилмочевины (СМ) и инсулин человека. В консенсусе АДА/ЕАИД этапы лечения СД 2-го типа представлены в виде шагов, а контроль эффективности оценивают по уровню гликозилированного гемоглобина (НbА1с, рис. 1). Первый шаг заключается в коррекции образа жизни и назначении оптимальной дозы метформина (1700–2000 мг/день). При неэффективности предыдущей терапии к ней добавляют препараты инсулина или сульфонилмочевины новой генерации. В глобальном руководстве Международной федерации диабета лечение СД 2-го типа рекомендуется начинать с коррекции образа жизни с дальнейшим переходом к применению метформина при отсутствии противопоказаний, а затем применять препараты СМ. Данные препараты часто считаются фармакологическими средствами первой линии для пациентов с нормальной массой тела.
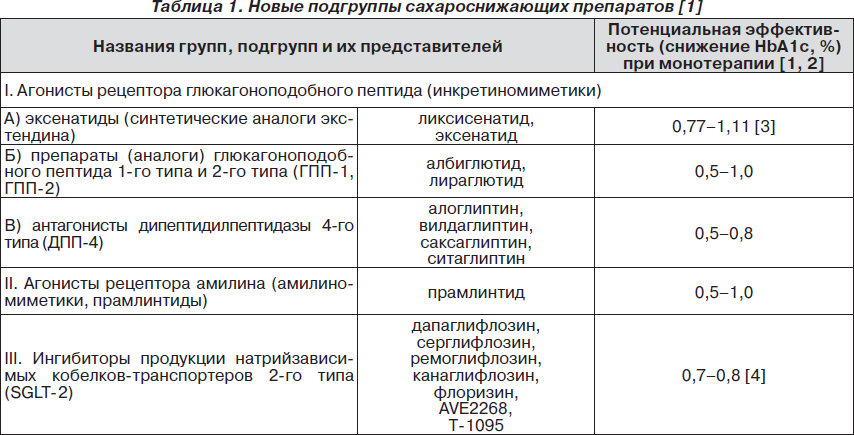
Новые подгруппы сахароснижающих препаратов
2010–2011 годы ознаменовались появлением в аптеках Украины сразу нескольких представителей новых, революционных по своей сути подгрупп сахароснижающих препаратов, явившихся результатом научных достижений в области физиологии, патофизиологии, молекулярной биологии и клинической фармакологии (табл. 1).
Их создание связано с достижениями в познании механизмов регуляции и действия гормонов, участвующих в регуляции углеводного обмена, которые раньше не удавалось использовать в терапии СД [3, 4]. Действительно, эти препараты будут полезны ряду больных, но не всем (!) при комбинированном лечении СД.
Однако уже сегодня известно, что они обладают рядом принципиальных недостатков, которые заставляют относиться к ним очень осторожно и препятствуют их широкому применению в клинической практике [3]. Часто желаемое выдается за действительное. Прежде всего следует учитывать, что агонисты рецептора глюкагоноподобного пептида (антагонисты ДПП-4 и аналоги ГПП-1) обладают недостаточно высоким сахароснижающим эффектом (в среднем 0,5–1,0 % НbА1с) при использовании монотерапии.
С другой стороны, эти новые препараты обладают недостаточно изученной безопасностью как в ближайшем периоде, так и в отдаленном (последствия абсолютно неизвестны). Прежде всего интересует их влияние через 5–10 лет на развитие сердечно-сосудистых и онкологических заболеваний, а также вероятность повышения риска смерти.
Уже имеются официальные предостережения Управления по контролю за качеством пищевых продуктов и лекарственных средств (FDA) относительно применения эксенатида, антагонистов ДПП-4 и аналогов ГПП-1 в связи с риском развития случаев острого панкреатита и других нежелательных побочных реакций (НПР).
Так, к февралю 2009 года в Медицинское агентство Великобритании (MHRA) поступили сообщения о подозреваемых побочных реакциях эксенатида, зафиксировано несколько летальных исходов, 9 из них ассоциировались с некротическим и геморрагическим панкреатитом. К сентябрю 2008 года во всем мире было зарегистрировано 396 сообщений (из 800 тыс. назначений) о случаях развития панкреатита. В нескольких сообщениях отмечалось возобновление НПР при повторном назначении препарата. Информация об этих НПР была внесена в инструкцию по применению эксенатида. Кроме того, в MHRA поступило 7 сообщений об острой почечной недостаточности, связанной с приемом эксенатида. В связи с этим MHRA напоминает, что эксенатид не рекомендуется назначать пациентам с тяжелым поражением почек и почечной недостаточностью [6].
Аналоги ГПП-1 не следует применять у пациентов с СД 1-го типа, при диабетическом кетоацидозе, нефропатии, тяжелой патологии ЖКТ, а также с осторожностью назначать тем, кто получает противозачаточные средства, антибиотики. Помимо этого, имеется риск развития патологии щитовидной железы при их использовании.
В начале 2010 года FDA предупредила о случаях острого панкреатита при применении ситаглиптина. За период с октября 2006 по февраль 2009 года FDA получило 88 сообщений о случаях развития острого панкреатита, включая 2 случая геморрагической или некротической формы. Врачам рекомендовано внимательно наблюдать за состоянием пациентов, чтобы не пропустить признаки развития панкреатита, особенно в начале терапии или при повышении дозы ситаглиптина, а также при применении комбинации ситаглиптин + метформин. Помимо этого, при применении антагонистов ДПП-4 зафиксированы изменения активности иммунной системы и увеличение частоты развития инфекций верхних дыхательных путей.
Таким образом, новые сахароснижающие препараты подгруппы агонистов рецептора глюкагоноподобного пептида 1-го типа являются достаточно дорогостоящими, что в комбинации с недостаточной сахароснижающей эффективностью (по сравнению с традиционными метформином и препаратами СМ), а также с точки зрения фармакоэкономики делает их нерентабельными и ограничивает их использование. В настоящее время большая часть этих новых сахароснижающих препаратов проходят III фазу клинических исследований, в том числе в Украине, и уже ясно, что не все из них будут одобрены для широкого клинического применения. С другой стороны, если закрыть глаза на вероятность развития нежелательных эффектов, эти препараты могут применяться в комбинированной терапии сахарного диабета по принципам Консенсуса ADA/EASD, например с метформином, препаратами сульфонилмочевины или инсулином, до момента выяснения их безопасности (или опасности) для сердечно-сосудистой системы, как в ближайшем, так и в отдаленном периоде.
Препараты сульфонилмочевины
Длительно действующие препараты СМ первого поколения, такие как хлорпропамид, обусловливали большое количество случаев гипогликемии и других побочных эффектов, таких как задержка жидкости, гипонатриемия, а также случаев взаимодействия с множеством других лекарственных средств и алкоголем, в связи с чем в настоящее время применяются редко. Препараты СМ второго поколения, такие как гликлазид, глипизид, глибенкламид и глимепирид, с другой стороны, в большинстве случаев обладали более высокой безопасностью, демонстрируя низкую частоту случаев гипогликемии.
Из таблетированных сахароснижающих препаратов новой генерации — производных сульфонилмочевины — наибольшего внимания заслуживает глимепирид, выпускаемый под названием Амарил®, за счет удачного сочетания высокой сахароснижающей активности, во многом определяемой непрямыми, не связанными с воздействием на бета-клетки (внепанкреатическими) эффектами.
Поэтому часто глимепирид (Амарил®) классифицируют как препарат СМ третьего поколения. Впервые он введен в клиническую практику в Швеции, а в 1995 году был одобрен Управлением по контролю за качеством пищевых продуктов и лекарственных средств США и с того времени применяется в 60 странах мира. Преимуществом глимепирида является его быстрая и полная абсорбция, а также однократный прием в течение суток.
Как и традиционные препараты СМ, Амарил® стимулирует секрецию инсулина путем нормализации деятельности КАТФ+-каналов и каскада биохимических реакций, которые обусловливают его отличие от других препаратов СМ. В то время как остальные препараты связываются на клеточной мембране b-клетки с рецептором, молекулярная масса которого составляет 140 кДа, Амарил® связывается с субъединицей этого рецептора массой 65 кДа, что позволяет ему в 2,5–3 раза быстрее связываться со своим рецептором. Таким образом, глимепирид обладает быстрым началом действия и краткосрочным (в 8–9 раз быстрее) высвобождением (диссоциированием с рецепторным аппаратом b-клетки), что обусловливает менее выраженное стимулирование этих клеток, меньшее повышение выброса инсулина и, как следствие, более редкое развитие нежелательных эффектов препарата и гипогликемических реакций по сравнению с другими «похожими» сахароснижающими препаратами [9]. В крупном проспективном исследовании у пациентов отмечено меньшее количество случаев тяжелой гипогликемии, равное 0,86/1000 человеко-лет, по сравнению с теми, которые принимали глибенкламид (глибурид), — 5,6/1000 человеко-лет [10].
Также в проведенных исследованиях было показано: глимепирид не влияет на защитный механизм «ишемического прекондиционирования» миокарда, что свидетельствует о преимуществах его использования у пациентов с СД 2-го типа с ИБС по сравнению с другими препаратами СМ [11, 12].
Комбинированная терапия сахарного диабета 2-го типа
У всех пациентов с СД 2-го типа, у которых из-за прогрессирования заболевания рано или поздно монотерапия становится неэффективной, в дальнейшем необходимо применение комбинированной терапии. Во многих исследованиях изучалось применение разных комбинаций препаратов различных механизмов действия как способа поддержания гликемического контроля, прежде всего с инсулинами.
Charpentier изучал применение комбинированной терапии метформином и глимепиридом у 327 пациентов с недостаточно контролируемым СД 2-го типа на фоне монотерапии метформином. Было выделено три исследуемые группы: метформина, глимепирида и группа метформин + глимепирид. В исследовании отмечалось, что комбинация глимепирида и метформина была значительно более эффективной для улучшения гликемического контроля, чем каждый препарат по отдельности.
McCluskey et al. в многоцентровом двойном слепом плацебо-контролируемом исследовании изучали эффективность применения комбинации розиглитазона и глимепирида по сравнению с розиглитазоном и плацебо. В группе глимепирида целевое значение HbA1C < 7 % достигалось чаще (60 против 14,3 %; р < 0,006). Также какой-либо значительной разницы в частоте и типах побочных реакций между группами не отмечалось, а также ни в одной группе лечения не зарегистрировано эпизодов тяжелой гипогликемии.
Umpierrez et al. в исследовании, посвященном сравнению эффективности назначения дополнительного медикаментозного лечения глимепиридом или пиоглитазоном пациентам с СД 2-го типа, недостаточно контролируемым стабильными дозами метформина, показал, что добавление глимепирида или пиоглитазона в одинаковой мере приводило к общему улучшению гликемического конт-роля. Однако для пациентов, получавших глимепирид, были характерны более быстрое установление гликемического контроля (несмотря на большую распространенность гипогликемии), более низкие уровни общего холестерина и ЛНП, а также снижение краткосрочных затрат в сфере здравоохранения в ходе исследования.
У тех пациентов, у которых не удалось достичь адекватного гликемического контроля в ответ на применение комбинированной терапии пероральными средствами, приходится прибегать к использованию препаратов инсулина человека. Комбинация глимепирид + инсулин является наиболее изученной и единственной, которая получила одобрение к применению FDA (США) [14]. Из всех форм препаратов инсулина, доступных в Украине, наиболее прогрессивными являются аналоги инсулина человека, обладающие рядом преимуществ, в частности лучшим прогнозом действия и меньшим риском развития гипогликемий. В соответствии с консенсусом АДА/ЕАИД в комбинированной терапии СД 2-го типа должны применяться базальные инсулины (второй шаг), лучшим из которых является гларгин (Лантус®).
Выводы
В группе препаратов сульфонилмочевины средством выбора для лечения пациентов с СД 2-го типа, у которых не был достигнут рекомендованный гликемический контроль путем изменения образа жизни (диета и физические нагрузки) и применения монотерапии метформином, является глимепирид. В настоящее время в Украине доступен оригинальный препарат глимепирида Амарил® с кратностью приема один раз в сутки и с истинным пролонгированным действием. Применение Амарила® способствует не только нормализации гликемии за счет стимуляции секреции инсулина бета-клетками, но и за счет выраженных внепанкреатических свойств, что нивелирует прогрессирование СД и его осложнений, в том числе посредством улучшения эндотелиальной функции (ангиопротекция), снижения уровней провоспалительных цитокинов и т.п.
Амарил® способствует хорошему уровню качества жизни и высокой приверженности пациента к терапии, так как при его приеме от пациента не требуется соблюдения периода ожидания (30–45 минут перед приемом пищи), и он назначается 1 раз в сутки. Амарил® выпускается в трех различных дозировках: 2, 3 и 4 мг, что позволяет подобрать максимально эффективную дозу для каждого пациента. Помимо этого, имеется комбинированная форма Амарила с метформином — Амарил-М.
В последнее время все большее внимание исследователей стали привлекать не только клинические, но и экономические аспекты терапии СД, поэтому в фармакоэкономическом исследовании U.M. Kabadi были учтены вышеперечисленные оригинальные эффекты глимепирида (Амарил®), а также стоимость этого препарата и сделано заключение, что монотерапия глимепиридом или комбинация его с другими сахароснижающими препаратами (с метформином или инсулином) являются экономически наиболее целесообразными [13].
1. Nathan D. et al. Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy. A consensus statement from the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. — 2006. — Vol. 29. — P. 1963-1972.
2. Nathan D. et al. Medical Management of Hyperglycemia in Type 2 Diabetes: A Consensus Algorithm for the Initiation and Adjustment of Therapy: A consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes // Diabetes Care. — 2009. — Vol. 32. — P. 1-30.
3. Asfandyar Khan Niazi, Saad Hameed Niazi A novel strategy for the treatment of diabetes mellitus — sodium glucose co-transport inhibitors // North American Journal of Medical Sciences. — 2010 December. — Vol. 2. № 12. — 556-560.
4. Norton L., DeFronzo R., Abdul-Ghani M. Sodium–Glucose Co-transporter 2 Inhibition — A Novel Strategy for Glucose Control in Type 2 Diabetes // US Endocrinology. — 2010. — 6. — 42-7.
5. Каминский А.В., Коваленко А.Н. Сахарный диабет и ожирение: клиническое руководство по диагностике и лечению. — Киев: Салютис, 2010. — 256 с.
6. Аметов А.С., Пьяных О.П., Ильичева А.В. Последние достижения в лечении сахарного диабета типа 2: эксенатид — первый экзогенный миметик инкретина глюкагоноподобного пептида-I // Фарматека. — 2008. — № 3. — С. 10-15.
7. WHO Pharmaceutical Newsletter. — 2009. — № 2. — Р. 3 (www.mhra.gov.uk).
8. Drug Safety Update, MHRA. — 2009. — I. 9, v. 2. — (http://www.regmed.ru/etap.asp?EtapNx=236).
9. Muller G., Hartz D., Punter J. et al. Differential interaction of glimepiride and glibenclamide with the b–cell sulfonylurea receptor. II Photoaffinity labeling of a 65 kDa protein by [3H] glimepiride // Biochim BiophysActa. — 1994. — 1191. — P. 267-277.
10. Holstein A., Plaschke A., Egberts E.H. Lower incidence of severe hypoglycaemia in patients with type 2 diabetes treated with glimepiride versus glibenclamide // Diabetes. Metab. Res. Rev. — 2001. — 17(6). — Р. 467-473.
11. Александров А.А. Сахароснижающая терапия и сердце: бремя доказательств // Consilium Medicum. — 2002. — Т. 4, № 10. — C. 551-554.
12. Klepzig H., Kober G., Matter C., at al. Sulfonylureas and ischemic preconditioning; a double-blind, placebo-controlled evaluation of glimepiride and glibenclamide // Eur. Heart. J. — 1999. — 20. — P. 439.
13. Kabadi U.M. Cost-effective management of hyperglycemia in patient with type 2 diabetes using oral agents // Managed Care. — 2004. — 6. — Р. 48-59.
14. Garber A.J. Benefits of combination therapy of insulin and oral hypoglycaemic agents // Arch. Intern. Med. — 2003. — 163(15). — 1781-2.