Международный эндокринологический журнал 2 (34) 2011
Вернуться к номеру
Стан внутрішньоренальної гемодинаміки в дітей, хворих на цукровий діабет, залежно від застосованої схеми інсулінотерапії
Авторы: Леженко Г.О., Пашкова О.Є., Запорізький державний медичний університет
Рубрики: Эндокринология
Версия для печати
У роботі проведено дослідження стану ренальної гемодинаміки в дітей, хворих на цукровий діабет, залежно від схеми застосованої інсулінотерапії. Показано, що на відміну від НПХ-інсулінів використання в терапії цукрового діабету аналогів людських інсулінів гларгін та глюлізин сприяє уповільненню темпів виникнення діабетичної нефропатії за рахунок нормалізації ниркової гемодинаміки.
Цукровий діабет, ренальна гемодинаміка, інсулінотерапія, діти.
В останні десятиріччя цукровий діабет (ЦД) став міжнародною проблемою. Упродовж життя дане захворювання розвивається в 1 з 10 осіб, і поширеність його в усьому світі незалежно від етнічної групи та соціально-економічного рівня неухильно зростає, зокрема в дітей і підлітків [12]. При цьому ускладнення ЦД стають головним економічним тягарем в охороні здоров’я. Прямі витрати на лікування ЦД та його ускладнень становлять від 2,5 до 15 % щорічного бюджету охорони здоров’я в усьому світі (www.who.int).
За даними S. Arslanian (2008), 40 % пацієнтів, яким діагноз ЦД був поставлений до 20-річного віку, мають тяжкі мікросудинні ускладнення навіть при тривалості захворювання, меншій за 10 років [7]. При цьому найбільш тяжким проявом діабетичної мікроангіопатії залишається ураження нирок. За останні 50 років смертність від патології нирок серед хворих на ЦД зросла більше ніж удвічі. За даними літератури [6], фінальна стадія діабетичної нефроангіопатії — діабетичний гломерулосклероз — розвивається у 30–50 % хворих на ЦД 1-го типу.
Однією з патогенетичних ланок діабетичної нефропатії є зміни внутрішньоренальної гемодинаміки. Ультразвукові методи дозволяють реєструвати кровотік на різних рівнях судинного русла, якісно й кількісно оцінити стан гемодинаміки нирок. Раніше в наших роботах було показано, що відмінною рисою гемодинамічних порушень у нирках при розвитку діабетичної нефропатії в дітей є залучення до процесу, окрім судин дрібного калібру, судин більшого калібру, що проявляється не тільки зміною швидкісних параметрів кровотоку в міжчастковій і сегментарній ниркових артеріях, але і зниженням пікового градієнта швидкості та підвищенням індексів периферичного опору в ниркових артеріях. Результати проведених нами досліджень ниркової гемодинаміки в дітей, хворих на ЦД 1-го типу, свідчать про те, що ультразвукові ознаки порушення її можуть визначатися вже в перші роки захворювання до появи мікроальбумінурії, характерної для розвитку діабетичної нефропатії. При цьому вираженість порушень гемодинаміки при ЦД 1-го типу в дітей залежить від тривалості захворювання. При збільшенні тривалості перебігу ЦД показники внутрішньониркового кровотоку в дітей мають тенденцію до зниження в ниркових артеріях різного калібру [2].
Відповідно до Сент-Вінсентської декларації, основний напрям медико-соціальної політики щодо ЦД — мінімізація ускладнень захворювання [1]. Дослідження Diabetes Control and Complications Trial (DCCT) довело, що інтенсифікований режим інсулінотерапії знижує ризик розвитку діабетичної ретинопатії на 76 %, а також знижує кардіоваскулярні ускладнення на 57 % за рахунок зменшення рівня HbА1c до 7 % [9]. З появою в 1995 році аналогів інсуліну ультракороткої дії були відкриті широкі можливості контролю глікемії залежно від вибору режиму споживання вуглеводів та рекомендовані жорсткіші вимоги до контролю післяпрандіальної глікемії. International Diabetes Federation (IDF) були визначені цільові значення післяпрандіальної глікемії — менше 7,5 ммоль/л. Згідно з даними різних авторів, саме значні коливання глікемії за межами рекомендованих цільових значень є першопричиною розвитку ускладнень ЦД [11].
Нова ера аналогів інсуліну пролонгованої безпікової дії, що використовуються в діабетологічній практиці останні п’ять років, дозволила скоротити до мінімуму коливання глікемії протягом доби. Одним із таких препаратів є інсулін гларгін (Лантус®) — базальний аналог людського гормону 24-годинної дії. У цьому препараті в 21-му положенні А-ланцюга молекули інсуліну амінокислота аланін замінена на гліцин, а в 30-му положенні В-ланцюга додано дві молекули амінокислоти аргінін. Завдяки таким змінам у структурі інсулін гларгін розчиняється в кислому середо-вищі (рН 4,0), а після введення в підшкірну жирову клітковину утворюється мікропреципітат, що містить інсулін гларгін (pH 7,4), а з мікропреципітату починаються вивільнення гексамерів інсуліну гларгін і їх дисоціація з утворенням димерів і мономерів. Поступове проникнення димерів і мономерів через капілярну мембрану забезпечує постійний і стабільний рівень інсуліну в крові протягом доби. Такі характеристики обумовлюють сповільнений і пролонгований профіль абсорбції без виражених піків концентрації гларгіну в крові. Ін’єкція модифікованого таким чином інсуліну не викликає виникнення в крові пікових концентрацій препарату, що істотно знижує ризик розвитку гіпоглікемічних станів у перервах між прийомами їжі. Нещодавно проведені клінічні дослідження продемонстрували здатність інсуліну гларгін (Лантус®) на 25 % збільшити кількість пацієнтів, які досягли цільових рівнів — НbA1с < 7 % при зниженні на 42 % виникнення кількості епізодів нічних гіпоглікемій [4].
Якщо інсулін гларгін забезпечує досягнення цільового рівня НbA1с за рахунок якісного контролю глікемії натщесерце, то ще один сучасний препарат — інсулін глюлізин дозволяє ефективно й безпечно усувати післяпрандіальну гіперглікемію [10]. Новий препарат був створений після модифікації у В-ланцюзі молекули інсуліну: у положенні 3 амінокислота аспарагін замінена на лізин, а в положенні 29 лізин замінений на глутамінову кислоту. Крім того, як стабілізатор у новий препарат не включений традиційний цинк, здатний уповільнювати настання гіпоглікемічного ефекту. Завдяки цим змінам інсулін має фармакокінетичні переваги над традиційним людським інсуліном короткої дії: швидкий початок дії (через 5–15 хвилин після ін’єкції), досягнення піку концентрації (через 1–2 години) і менша тривалість дії (3–4 години). Така відмітна особливість глюлізину дозволяє йому діяти однаково швидко й фізіологічно в пацієнтів із різною товщиною підшкірної жирової клітковини [5, 8].
Якщо ж інсулін гларгін (Лантус®) та інсулін глюлізин (Епайдра®) використовувати для лікування хворих на цукровий діабет спільно, то вони здатні практично повністю відтворити фізіологічний інсуліновий профіль людини, демонструючи при цьому мінімальний ризик виникнення гіпоглікемій, обумовлених адитивною дією препаратів. Зважаючи на це, їх комбінацію слід визнати оптимальною для інтенсивного режиму інсулінотерапії ЦД [3].
Мета дослідження — оцінити стан ниркової гемодинаміки за даними допплерівського ультразвукового обстеження в дітей, хворих на ЦД, залежно від застосованої схеми інсулінотерапії.
Матеріали і методи дослідження
Оцінку ниркової гемодинаміки за даними допплерівського ультразвукового обстеження визначали в 60 хворих на ЦД дітей віком від 9 до 16 років. 1-ша група отримувала стандартну базально-болюсну терапію з використанням НПХ-інсулінів (35 дітей, середній вік — 12,8 ± 0,8 року), у 2-й групі інсулінотерапія проводилася із застосуванням аналогів людських інсулінів короткої та 24-годинної дії — інсулінів гларгін та глюлізин (25 хворих, середній вік — 13,1 ± 1,0 року). Середня тривалість ЦД в 1-й групі становила 5,1 ± 0,7 року, у 2-й — 5,3 ± 0,9 року. Тривалість лікування на відповідних режимах інсулінотерапії була не менше 2 років. Критерієм включення в обстеження була відсутність грубих аномалій розвитку й ознак активного запального процесу з боку сечовивідної системи. На момент обстеження в усіх пацієнтів показники артеріального тиску не перевищували вікової норми. Контрольну групу становили 20 умовно здорових дітей, репрезентативних за віком та статтю.
Дослідження ниркової гемодинаміки виконувалося на ультразвуковому сканері Medison 8000 з використанням датчика з частотою 50 МГц. При цьому проводили кольорове картирування з метою візуалізації артерій та імпульсно-хвильову допплерографію — для визначення швидкісних характеристик кровотоку. У режимі кольорового картирування уточнювали положення судини, а також її хід та характер галуження, потім у режимі імпульсної допплерографії визначали спектр швидкостей кровотоку з обов’язковою корекцією кута нахилу площини ультразвукового променя. При цьому кут нахилу максимально збігався з розташуванням довгої осі судини саме на тому відрізку судини, де встановлювали контрольний об’єм. Обстеження хворих проводили після 12-годинного голодування та промивання кишечника в положенні пацієнта на спині. Спочатку отримували сагітальний перетин через черевну аорту і знімали спектр швидкостей потоку в аорті. Орієнтиром для знаходження ниркової артерії був черевний стовбур, ліва ниркова вена.
Ниркові артерії визначали з переднього доступу по серединній лінії живота. Для візуалізації внутрішньосинусних і паренхіматозних судин використовували задньолатеральний доступ. Ліву ниркову артерію досліджували в положенні пацієнта на лівому боці. Датчик встановлювали по передній аксилярній лінії й отримували поздовжній зріз нирки.
Для визначення стану ниркової гемодинаміки проводили оцінку таких величин:
1. Vmax — максимальна систолічна швидкість артеріального потоку.
2. Vmin — кінцева діастолічна швидкість.
3. Показники резистивності судин:
а) RI — індекс резистивності (індекс периферичного опору);
б) PI — пульсаційний індекс.
4. Піковий градієнт швидкості кровотоку в судинах (ПГШ).
Обчислення РІ та RІ, що характеризують кінцеву частину комплексу кривої швидкостей кровотоку та відображають стан мікроциркуляторного русла нирки, проводили за формулами:
RI = (Vmax – Vmin)/Vmax;
PI = (Vmax – Vmin)/Vсер.,
де Vсер. — усереднена за часом максимальна швидкість кровотоку протягом усього серцевого циклу.
Результати дослідження та їх обговорення
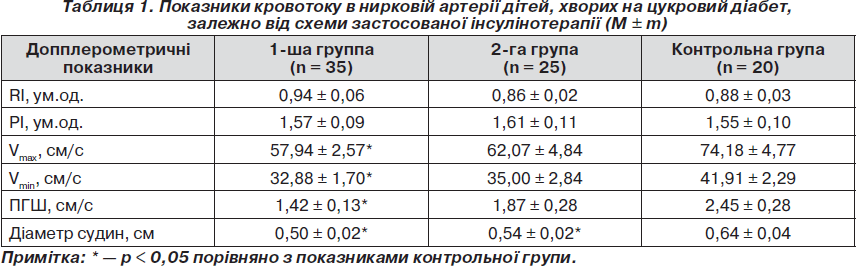
Проведений нами аналіз допплерографічного дослідження судин нирок показав, що застосована схема інсулінотерапії суттєво впливала на стан ренального кровотоку. Так, як свідчать дані табл. 1, у групі хворих, які отримували терапію НПХ-інсулінами, порівняно з контрольною групою у ниркових артеріях спостерігалося вірогідне зниження Vmax та Vmin в 1,3 раза, а пікового градієнта швидкості — в 1,7 раза (р < 0,05). У той же час у групі хворих, у терапії яких було застосовано аналоги людських інсулінів гларгін та глюлізин, хоча і спостерігалася тенденція до зниження швидкісних показників кровотоку в ниркових артеріях, проте воно не набувало статистичної значущості.
Слід підкреслити, що в обох групах спостереження поряд зі зниженням швидкісних показників також спостерігалося вірогідне зменшення діаметра ниркових судин. При цьому найбільші зміни ниркових судин спостерігалися в групі пацієнтів, які отримували НПХ-інсуліни, діаметр ниркових судин у яких становив 0,50 ± 0,02 см проти 0,64 ± 0,04 см у групі контролю (р < 0,05). Привертало увагу те, що в групі хворих, у терапії яких було застосовано комбінацію аналогів людських інсулінів гларгін та глюлізин, діаметри ниркових артерій хоча й були вірогідно меншими, ніж у контрольній групі (0,54 ± 0,02, р < 0,05), проте максимально наближалися до нормативних показників.
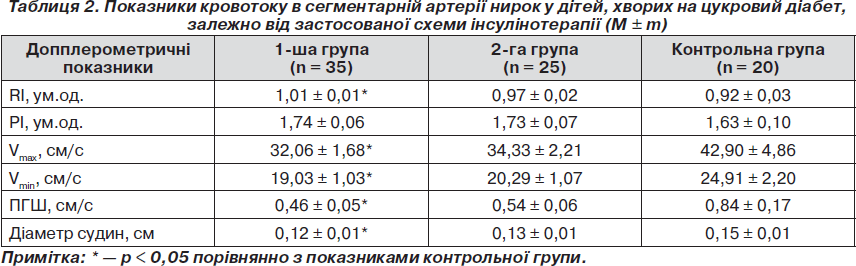
Аналіз гемодинаміки в сегментарній артерії, результати якого наведено в табл. 2, свідчив, що застосування НПХ-інсулінів також не забезпечувало належного кровотоку на даному рівні судин. Так, у хворих даної групи спостерігалося зниження усіх швидкісних показників порівняно з аналогічними значеннями контрольної групи. Крім того, у пацієнтів, які отримували НПХ-інсуліни, відбувалося підвищення індексу резистивності судин до 1,01 ± 0,01 ум.од. проти 0,92 ± 0,03 ум.од. у групі контролю (р < 0,05), що свідчило про підвищення тонусу судин та зниження їх еластичності.
Слід підкреслити, що тільки при застосуванні комбінації інсулінів гларгін і глюлізин усі показники кровотоку на рівні сегментарних артерій статистично не відрізнялися від показників здорових дітей. При цьому привертає увагу той факт, що діаметр сегментарних артерій був зниженим тільки в 1-й групі хворих, тоді як у групі пацієнтів, які отримували комбінацію аналогів людських інсулінів гларгін та глюлізин, даний розмір судин не відрізнявся від параметрів контрольної групи.
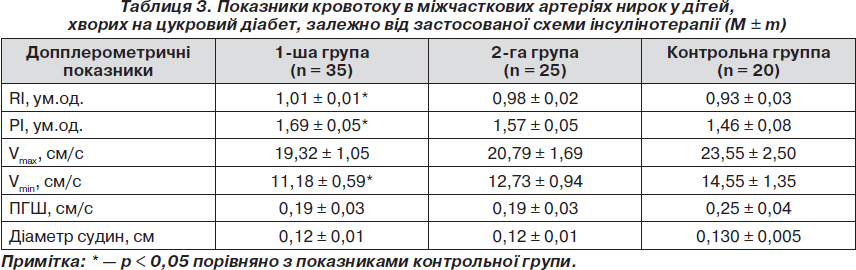
Як свідчать дані табл. 3, кровотік на рівні міжчасткових артерій у групі пацієнтів, які отримували НПХ-інсуліни, також характеризувався зниженням швидкісних показників. Так, Vmax у даній групі хворих порівняно з контрольною групою була зниженою до 19,32 ± 1,05 см/с, Vmin — до 11,18 ± 0,59 см/с, у той час як нормативні показники cтановили відповідно 23,55 ± 2,50 см/с та 14,55 ± 1,35 см/с (р < 0,05). Крім того, у пацієнтів даної групи поряд зі зниженням швидкісних показників, як і на рівні сегментарних артерій, спостерігалося підвищення показників резистивності судин. Одержані дані виглядають логічно на тлі результатів декількох досліджень, у яких порівнювали фармакокінетику й фармакодинаміку Лантусу та традиційних генно-інженерних базальних НПХ-інсулінів. Для вирішення поставлених завдань застосовували еуглікемічний клемп-тест або мічені радіоактивним йодом препарати інсуліну. Результати засвідчили уповільнену і значно пролонговану абсорбцію, а також відсутність піку концентрації в інсуліну гларгін порівняно з НПХ-інсулінами. Завдяки особливостям фармакодинаміки одноразове введення гларгіну дозволяло протягом 24 годин максимально імітувати фізіологічну базальну секрецію, що значно знизило ризик гіпоглікемії та варіабельність концентрації глюкози порівняно з інсулінами НПХ [13].
На відміну від першої групи хворих у групі пацієнтів, які застосовували комбінацію аналогів людських інсулінів гларгін та глюлізин, гемодинаміка на рівні як міжчасткових, так і сегментарних артерій була найбільш оптимальною. Слід зазначити, що діаметр міжчасткових судин не залежав від схеми застосованої терапії та в усіх групах хворих статистично не відрізнявся від значень контрольної групи.
Таким чином, як показали результати нашого дослідження, у групі хворих, які отримували НПХ-інсуліни, нирковий кровотік був порушеним. Найбільш суттєві зміни у хворих даної групи виявлено на рівні сегментарних та міжчасткових артерій, що проявлялося не тільки зниженням швидкісних показників, але й підвищенням індексів резистивності судин, що вказує на порушення пружно-еластичних властивостей судин, тобто появу не тільки функціональних, але й структурних ознак ремоделювання ренальної гемодинаміки. Навпаки, у групі хворих, які застосовували комбінацію інсулінів гларгін та глюлізин, показники ренальної гемодинаміки майже не відрізнялися від значень контрольної групи, тобто застосування зазначеної схеми інсулінотерапії сприяє уповільненню темпів виникнення одного з ускладнень ЦД в дітей — діабетичної нефропатії.
Висновки
1. На стан ниркової гемодинаміки в дітей, хворих на цукровий діабет, суттєво впливає застосована схема інсулінотерапії.
2. При застосуванні НПХ-інсулінів стан гемодинаміки нирок характеризується не тільки зниженням швидкісних показників, але й підвищенням індексів резистивності судин, що вказує на порушення пружно-еластичних властивостей судин та наявність ознак ремоделювання ренальних судин.
3. Використання комбінації аналогів людських інсулінів гларгін (Лантус®) та глюлізин (Епайдра®) у дітей, хворих на цукровий діабет, сприяє зниженню ризику розвитку і прогресування діабетичної нефропатії за рахунок нормалізації ниркової гемодинаміки.
1. Анциферов М.Б., Ростовцева Я.Г. Сахарный диабет: принципы медико-социальной защиты больных. — М., 1997. — 148 с.
2. Леженко Г.О., Пашкова О.Є., Чакмазова О.М. Особливості формування, клініки та терапії діабетичної нефропатії у дітей, хворих на цукровий діабет І типу (сучасні погляди на стан проблеми) // Мат-ли наук.-практич. конференції «Інноваційні технології в сучасній ендокринології». — Харків, 2008. — С. 60-67.
3. Панчук С.Н. Оптимальная комбинация интенсивной инсулинотерапии // Medicus Amicus. — 2008. — № 2 // www.medicusamicus.com
4. Парфенюк Б. Лантус — революція в лікуванні цукрового діабету // Аптека.ua.online. — 2003. — № 393(22) // http://www.apteka.ua/article/14115
5. Полторак В.В., Караченцев Ю.І., Горшунська М.Ю. Нові рекомбінантні аналоги інсуліну як засіб оптимізації глікемічного контролю у хворих на цукровий діабет // Проблеми ендокринної патології. — 2005. — № 4. — С. 54.
6. Шестакова М.В., Шамхалова М.Ш., Чугуно- ва Л.А. Диабетическая нефропатия: диагностика, лечение, профилактика, качество жизни // Сахарный диабет. — 2003. — № 3. — С. 23-28.
7. Arslanian S. Managеment of T1DM from children to adults. Diabetes Faculty Forum. — Barselona, 2008. — Р. 24.
8. Aventis Pharmaceuticals Inc. APIDRATM prescribing information. — Kansas City, Missouti, USA, April 2004.
9. Diabetes Control and Complications Trial Research Group // N. Engl. J. Med. —1993. — Vol. 329. — Р. 977-986.
10. Monnier L., Lapinski H., Colette C. Contributions of fasting and postprandial plasma glucose increments to the overall diurnal hyperglycemia of type 2 diabetic patients: variations with increasing levels of HbA(1c) // Diabetes Care. — 2003. — Vol. 26(3). — Р. 881-885.
11. The DIAMOND Project Group // Diabet. Med. — 2006. — Vol. 23. — Р. 857-866.
12. Zimmet P., Alberti K.G., Shaw J. Global and societal implications of the diabetes epidemic // Nature. — 2001. — Vol. 414. — Р. 782-787.
13. American Diabetes Association. Type 2 diabetes in children and adolescents. American diabetes association consensus statement // Diabetes Care. — 2000. — 23. — 381-389.