Международный эндокринологический журнал 1 (33) 2011
Вернуться к номеру
Возрастные аспекты кардиометаболических нарушений у пациентов с избыточной массой тела
Авторы: Трушкина И.В., Государственное образовательное учреждение высшего профессионального образования «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» и учреждение Российской академии
медицинских наук Научно-исследовательский институт кардиологии Сибирского отделения Российской академии медицинских наук
Рубрики: Эндокринология
Версия для печати
Введение
В экономически развитых странах в среднем каждый третий житель имеет массу тела, превосходящую максимально допустимую [1]. Среди взрослого населения Европейского региона на избыточную массу тела и ожирение ежегодно приходится около 80 % случаев сахарного диабета (СД) II типа, 35 % случаев ишемической болезни сердца и 55 % случаев гипертонической болезни (ГБ), а также свыше 1 миллиона смертей и 12 миллионов лет жизни с плохим здоровьем [2].
Истоки ожирения лежат в детском и подростковом возрасте, когда формируются основные пищевые пристрастия, привычки, образ жизни и идет становление обменных процессов в организме. Распространенность ожирения в детской популяции катастрофически растет как в России, так и за рубежом, и варьирует от 4,5 до 38% [3].
Ожирение является основным компонентом метаболического синдрома (МС), что и обусловливает его значимость для формирования сердечно-сосудистой патологии. Клиническая значимость нарушений и заболеваний, объединенных в рамках МС, заключается в том, что их сочетание в значительной степени ускоряет развитие и прогрессирование атеросклеротических сосудистых заболеваний. Изучение функциональных изменений сердца, сосудов, головного мозга в подростковом возрасте на этапе переходных или пограничных состояний, когда еще нет проявлений болезни в ее классической форме, имеет актуальное значение и требует дальнейшего глубокого исследования. Современная концепция возникновения компонентов МС предполагает наличие единого механизма их формирования вследствие нейрогуморальной дисрегуляции. Факторы риска начинают формироваться с детства. Если в зрелом возрасте возможно проводить исследования, связанные с последствиями и осложнениями ожирения, то у подростков можно проследить патогенетические пути развития метаболического дисбаланса. Большой интерес представляет проблема связи ожирения подросткового возраста с ожирением и другими метаболическими нарушениями у тех же пациентов, ставших взрослыми. В настоящее время отсутствуют критерии, позволяющие прогнозировать развитие МС в молодом возрасте, не определены и его доклинические маркеры. Остаются актуальными вопросы изменения структуры тела в процессе набора веса и взаимосвязи ее компонентов с гуморальным статусом.
Современная наука располагает рядом серьезных исследований по проблеме снижения массы тела. При этом большинство способов нормализации веса устраняют следствие, а не причину. Стратегия борьбы с ожирением, согласно рекомендациям ВОЗ, должна включать в себя диету, физическую активность, изменение образа жизни и фармакотерапию [4]. Разработка простых, доступных методов диагностики и лечения ожирения является актуальной проблемой современной медицины. Решение данной проблемы поможет прогнозировать риск развития кардиометаболических нарушений у пациентов с лишним весом в разных возрастных группах и позволит своевременно начать профилактические мероприятия по предупреждению как формирования МС в целом, так и дальнейшего прогрессирования его осложнений.
Цель исследования — установить закономерности кардиометаболических изменений у пациентов с избыточной массой тела в разных возрастных группах и разработать клинико-физиологическое обоснование метода немедикаментозной коррекции веса.
Материалы и методы исследования
В исследование включены подростки и взрослые пациенты с избыточной массой тела. Научная работа проводилась с 2005 по 2010 год и была выполнена в 2 этапа. Первый этап посвящен изучению особенностей клинической картины ожирения и ассоциированной с ним кардиоваскулярной патологии у подростков, изучению структуры тела при ожирении и изменению гормонального статуса в исследуемых когортах взрослых пациентов. На втором этапе изучалась динамика течения ожирения, артериальной гипертензии и других компонентов метаболического синдрома на фоне немедикаментозной терапии у молодых лиц, оценивалась эффективность программы снижения веса, ее влияние на структуру тела у взрослых пациентов и разрабатывался оптимальный курс коррекции веса.
В 2005–2008 гг. было обследовано 210 подростков с избыточной массой тела, из них 154 (73,3 %) юноши и 56 (26,7 %) девушек. Средний возраст обследованных составил 14,7 ± 1,9 года. Для проведения научной работы сформулированы критерии включения и исключения подростков в исследование.
Критерии включения: возраст на момент начала исследования от 12 до 18 лет включительно; индекс Кетле (ИК) более 24,9 кг/м2; первичные формы ожирения; повышение АД выше 95 ‰ для соответствующего пола, роста и возраста не менее чем на трех врачебных приемах с интервалом 10–14 дней; информированное согласие на участие в проводимом исследовании ребенка и его родителей.
Критерии исключения: возраст на момент начала исследования младше 12 и старше 18 лет; индекс Кетле менее 24,9 кг/м2; вторичные формы ожирения; морбидное ожирение; симптоматический характер артериальной гипертензии (АГ); СД I типа; пациенты, получающие препараты для снижения веса, коррекции инсулинорезистентности (ИР), гипотензивные препараты на момент запланированного обследования.
Разделение пациентов на группы наблюдения проведено по результатам антропометрии и расчета индекса Кетле для соответствующего пола и возраста, ориентированные на критерий избыточной массы тела (более 25кг/м2) и ожирения (более 30 кг/м2) у взрослых:
— 1-я группа — пациенты с избыточной массой тела (ИМТ) — 21 подросток (10 %);
— 2-я группа — с экзогенно-конституциональным ожирением I степени — 112 человек (53,3 %);
— 3-я группа — пациенты со II степенью ожирения — 60 подростков (28,6 %);
— 4-я группа — подростки с III степенью ожирения — 17 человек (8,1 %).
Группу контроля составили 22 практически здоровых подростка, сопоставимых с обследуемыми по полу и возрасту.
В период с 2007 по 2010 г. амбулаторно обследован 331 взрослый пациент с лишним весом в возрасте от 19 до 68 лет. Средний возраст составил 42,7 ± 10,6 года. Среди обследованных преобладали женщины репродуктивного возраста — 329 (89 %) чел.
Во взрослой когорте факт наличия повышения артериального давления не являлся основополагающим. На основании антропометрии взрослые пациенты также были разделены на группы наблюдения. За основу разделения была взята классификация по индексу Кетле [5]:
— 1-я группа — пациенты с избыточной массой тела (ИК 25–29,9 кг/м2) — 75 человек (20,4 %);
— 2-я группа — пациенты с ожирением I степени (ИК 30–39,9 кг/м2) — 111 человек (30,2 %);
— 3-я группа — пациенты со II степенью ожирения (ИК 35–29,9 кг/м2) — 82 человека (22,3 %);
— 4-я группа — пациенты с III степенью ожирения (ИК более 40 кг/м2) — 63 человека (17,1 %).
Дополнительно была обследована группа контроля, в которую вошли 37 практически здоровых людей. Существенных различий по половозрастному составу между группами не выявлено.
Дизайн исследования
Все пациенты проходили обязательное стандартное обследование, которое различалось у подростков и взрослых. Участники были осведомлены о научной стороне проблемы и дали свое согласие на участие в совместной работе. Подросткам проведен клинический осмотр, антропометрия, забор крови для биохимических и радиоиммунных исследований; инструментальные методы исследования: ЭКГ, ЭхоКГ, суточное мониторирование АД (СМАД), кардиоинтервалография, велоэргометрия, магнитно-резонансная томография (МРТ) головного мозга. Консультации невропатолога, окулиста, детского психотерапевта, эндокринолога. Для взрослых пациентов обследование включало в себя антропометрию, исследование состава тела, клинический осмотр, измерение уровня АД, ультразвуковое сканирование жировой ткани, психологическое тестирование для определения типа пищевого поведения, тест на скрытые депрессии, забор крови для иммуноферментного анализа. Пациенты проходили курс лечения, которое включало: 25 часов групповой психотерапии, составление индивидуальной редукционной диеты. По медицинским показаниям в индивидуальном порядке назначалась медикаментозная терапия. Динамическое наблюдение с клиническим осмотром, с проведением антропометрии, исследованием состава тела проводилось через 2 недели, 1, 3 и 12 месяцев от начала программы коррекции веса.
Инструментальные методы исследования
Антропометрическое исследование: измерение длины тела с точностью до 0,5 см и массы тела с точностью до 0,1кг. Измерение окружности талии: об избытке висцерального жира свидетельствует окружность талии > 94 см для мужчин и > 80 см для женщин. У подростков окружность талии оценивалась по процентильным таблицам.
Оценка уровня АД осуществлялась по таблицам перцентильного распределения АД с учетом возраста, роста, пола, предложенным экспертами Рабочей группы Национального института сердца, легких и крови (США). В соответствии с данными рекомендациями повышенное АД регистрировалось, когда значения систолического АД (САД) и/или диастолического АД (ДАД) превышали 95 ‰ распределения показателя для соответствующего возраста, роста и пола (Task Force Report on High Blood Pressure in Children and Adolescents: a working group from the National High Blood Pressure Education Program, 1996).
Состояние функции левого желудочка (ЛЖ) и центральной гемодинамики оценивали по данным эхокардиографии с помощью ультразвуковых сканеров Ultramark 9 HDI-ATL (США) и ASPEN (Acuson, США) по общепринятой методике. Массу миокарда левого желудочка (ММЛЖ) рассчитывали по формуле, предложенной R.B. Devereux (1995). Гипертрофия ЛЖ в подростковом возрасте диагностировалась в случае, когда индекс массы миокарда ЛЖ (ИММЛЖ) (г/м2,7) превышал 95 ‰ распределения для соответствующего пола (Daniels S.R. et al., 1999). Тип геометрической модели ЛЖ определяли, исходя из значений ИММЛЖ и индекса относительной толщины стенки (ОТС) ЛЖ (Ganau A. et al., 1992). За норму ОТС у детей и подростков принимали значение 0,41 (Daniels S.R. et al., 1988).
Суточное мониторирование артериального давления проводилось с помощью двух носимых мониторов АД— Medilog СХ фирмы Oxford (Англия) и BR-102 фирмы Sсhiller AG (Швейцария) по общепринятой методике (Петров В.И., Ледяев М.Я., 2006).
Магнитно-резонансная томография головного мозга проводилась на магнитно-резонансном томографе Magnetom-OPEN (Siеmens AG, Германия), имеющем резистивный магнит с силой магнитного поля 0,2 Тл. Для получения Т1- и Т2-взвешенных изображений использовалась импульсная последовательность Spin-Echo. Толщина срезов составляла 6 мм. У всех обследованных проводился визуально-качественный и количественный анализ полученной информации. Оценивались наличие и выраженность МРТ-проявлений внутричерепной гипертензии (ВЧГ), нарушение ликвородинамики и участки цереброваскулярной ишемии. Мы условно разделили признаки гипертензивной энцефалопатии (ГЭ) на две степени — минимальную и умеренную. Гипертензивная энцефалопатия считалась минимальной при изолированном расширении боковых желудочков или субарахноидальных пространств и/или наличии перивентрикулярной отечности. Умеренная степень ГЭ диагностировалась при расширении боковых желудочков в сочетании с увеличением субарахноидальных пространств и наличием перивентрикулярного отека.
Комплексную оценку вегетативного гомеостаза проводили с помощью автоматизированнной ритмографической программы «ЭКГ-триггер». Используя данные кардиоинтервалографии, оценивали исходный вегетативный тонус, вегетативную реактивность, вегетативное обеспечение и восстановительный период.
Велоэргометрия проводилась на велоэргометре Boso crofit фирмы Hormann (Германия). Использовался метод ступенчатой непрерывно возрастающей нагрузки с мощностью 1 ступени 25 Вт, продолжительностью каждой ступени 5 минут (Аронов Д.М., Лупанов В.П., 2003).
Исследование состава тела проводилось на анализаторе фирмы «Диамант» (Санкт-Петербург). Метод интегральной двухчастотной импедансометрии относится к неинвазивным методикам определения объемов жидкостных секторов и показателей структуры тела (патент № 2093069). Электрический и биологический смысл этого анализа заключается в измерении сопротивления (импеданса) собственных тканей организма или жидкостей до и после воздействия переменным током с различной частотой.
Методы статистического анализа
При статистической обработке клинико-функцио-нальных результатов использовались методы описательного статистического анализа, непараметрические методы выявления связей и проверки гипотез, а также методы многомерного моделирования. Результаты описательного анализа количественных параметров представлены в виде оценок выборочного среднего (Mеаn) и стандартного отклонения (SD), а также в виде медианы (Median) и верхнего — нижнего квартилей [Q1–Q3]. В качестве методов установления статистической значимости различий между группами по порядковому признаку применялись непараметрические методы (критерий Манна — Уитни, Вилкоксона, критерий знаков, дисперсионный анализ Краскела — Уоллиса). Для описания связей между порядковыми признаками использовался непараметрический корреляционный анализ: вычислялись ранговые корреляции Спирмена, а при большом числе повторяющихся значений порядкового признака— гамма-корреляции. При описании линейных связей между количественными признаками использовались методы простой и множественной линейной регрессии. Все статистические расчеты были проведены в программном пакете Statistica 6.1.
Результаты исследования и их обсуждение
Метаболические аспекты ожирения
Компоненты МС, сцепленные на патохимическом и патофизиологическом уровне, обусловливают чрезвычайно высокий риск развития сердечно-сосудистых заболеваний. Большой объем работы был посвящен изучению компонентов МС у пациентов с лишним весом в разных возрастных группах.
Сочетание ожирения с инсулинорезистентностью и стабильной формой АГ (СтАГ) диагностировано нами у 27,9 % подростков, сочетание гиперурикемии, ИР и ожирения — у 32,6 %.
Сформированный МС в детской популяции встречается достаточно редко, в то время как его отдельные компоненты широко распространены.
Ожирение. Обращает на себя внимание высокая частота абдоминального (висцерального) типа распределения подкожно-жировой клетчатки (ПЖК) среди подростков (55 %); гиноидный тип отмечен у 15 % и равномерное распределение подкожно-жировой клетчатки — у 30 % подростков. С ростом степени ожирения увеличивается доля висцерального типа ожирения. В когорте подростков не выявлено связи ИР с типом распределения ПЖК, в то время как связь относительного избытка массы тела с диагностированной инсулинорезистентностью была статистически значима (rs = 0,34; р = 0,03). Можно предположить, что для развития ИР в подростковом возрасте тип распределения ПЖК не носит основополагающей роли, любой избыток жировой ткани может привести к развитию ИР.
В когорте взрослых пациентов равномерное отложение жировых отложений выявлено у 43 % больных, в остальных случаях распределение подкожно-жировой клетчатки носило диспластический характер: андроидный тип ожирения отмечен у 36 % пациентов, гиноидный— у 21 %. С ростом степени ожирения увеличивается доля равномерного и андроидного типов распределения подкожно-жировой клетчатки, в то время как доля женского типа прогрессивно уменьшается независимо от пола. Механизм более злокачественного течения висцерального ожирения определяется тем, что при этой форме распределения жира гиперинсулинизм и инсулинрезистентность более выражены, чем при глютеофеморальном. Это подтверждает то, что частота встречаемости инсулинорезистентности в группе взрослых пациентов с абдоминальным типом значимо выше, чем с равномерным (дисперсионный анализ Краскела — Уоллиса; р <0,0001), а в группе с равномерным — значимо выше, чем в группе с гиноидным (дисперсионный анализ Краскела— Уоллиса; р < 0,0001).
Однако последний тип нельзя считать абсолютно безопасным в отношении развития ИР. При прогрессировании степени ожирения происходит утолщение внутреннего слоя подкожно-жировой клетчатки в области передней брюшной стенки (коэффициент корреляции Спирмена между индексом Кетле и толщиной глубокого слоя жировой ткани по данным ультразвукового исследования rs = 0,5; p < 0,001). Таким образом, любой избыток жировой ткани опасен в отношении развития МС.
Инсулинорезистентность и нарушение углеводного обмена. В плане оценки ИР наиболее надежным маркером признан индекс НОМА, который в норме не должен превышать 2,77. Среди подростков клинически значимая разница средних величин индекса НОМА по отношению к контрольной группе и группе пациентов с ИМТ была выявлена при всех степенях ожирения (Н = 11,2; р =0,01). Частота диагностики ИР у подростков с ожирением составила 44,2 %. Из них легкая степень (индекс НОМА 2,77–4) диагностирована в 54,5 % случаев, умеренная (индекс НОМА 4–6) — в 15,5 %, выраженной ИР (индекс НОМА > 6) была в 30 % случаев. По мере прогрессирования ожирения растет частота выявляемости ИР; так, в группе подростков с ИМТ индекс НОМА более 2,77 зарегистрирован у 16,7 %, при ожирении I степени— у 54,5%, при II степени — у 62,5 %, а при III степени большинство пациентов имели ИР — 89,5 %. Средние уровни глюкозы и иммунореактивного инсулина (ИРИ) в когорте подростков находились в пределах нормы, но последний увеличивался по мере роста степени ожирения и статистически значимо его уровни отличались от группы контроля и группы пациентов с ИМТ (р = 0,01). В то же время базальный уровень глюкозы достоверно не отличался от уровня глюкозы в контрольной группе.
По мере прогрессирования ожирения у взрослых повышается уровень и косвенных маркеров ИР: уровень тощакового сахара и ИРИ в сыворотке крови.
Корреляция индекса Кетле с уровнем глюкозы натощак носит прямой значимый характер (rs = 0,22; p < 0,001), аналогичная связь выявлена и с уровнем инсулина (rs = 0,53; p < 0,001). По мере увеличения степени ожирения у взрослых растет и частота регистрации тощаковой гипергликемии: от 9,1 % при ИМТ до 24,4 % при ожирении III степени, а также частота выявления гиперинсулинемии: от 9,4 % в группе с ожирением I степени до 52,6 % при III степени ожирения.
Частота встречаемости ИР у взрослых пациентов с лишним весом была сопоставима с таковой у подростков и составила 48,1 %. Повышение индекса НОМА зарегистрировано в единичных случаях при избыточной массе тела (6,7 %), у 52,2 % больных с ожирением I степени, у 48,8 % — со II и у 78,9 % пациентов с III степенью ожирения. Зависимость между индексом Кетле и индексом ИР носит прямой статистически значимый характер (rs=0,51; p < 0,001). Таким образом, как у взрослых, так и у подростков по мере увеличения веса растет частота нарушений углеводного обмена. Компенсаторные возможности детского организма позволяют длительное время удерживать уровень глюкозы в пределах нормы.
Дислипидемия. Групповых различий по уровню общего холестерина в исследуемой когорте подростков выявлено не было. Повышение уровня общего холестерина диаг-ностировано у 29,4 % пациентов. Гипертриглицеридемия является одним из основных маркеров МС, она зарегистрирована у 74,5 % подростков с лишним весом. Уровень триглицеридов (ТГ) увеличивается по мере прогрессирования ожирения: 1,0 [0,9–1,1] ммоль/л в группе контроля; 1,4 [1,0–1,9] ммоль/л в группе с ИМТ; 1,2 [1,0–2,0]ммоль/л при ожирении I степени и 1,5 [1,3–1,7]ммоль/л при ожирении II и III степени (коэффициент корреляции Спирмена с индексом Кетле rs = 0,33; р = 0,00002). Увеличение уровня липопротеидов низкой плотности менее выражено. Снижение антиатерогенной фракции липопротеидов выявлено у 69,7 % подростков исследуемой когорты, с постепенным уменьшением от 1,2 [1,1–1,5] ммоль/л в группе контроля до 1,0 [0,9–1,2]ммоль/л (коэффициент корреляции с индексом Кетле rs = –0,29; р = 0,00003) в группах с ожирением II и III степени.
Среди взрослых пациентов гиперхолестеринемия выявлена во всех группах наблюдения, включая контрольную. Повышение холестерина выше 5,2 ммоль/л диагностировано у 56,3 % пациентов из группы контроля, 68,2%— в группе с ИМТ, 56,8 % больных с I степенью ожирения, 47,5 % — II степенью и у 57,8 % — с III степенью. В то же время содержание ТГ в сыворотке крови у взрослых пациентов с лишним весом значимо отличается от группы контроля. Так, повышение ТГ у больных с III степенью ожирения выше, чем в группе контроля, более чем в 2 раза: 1,25 [1,07–1,90] и 0,61 [0,46–0,75] ммоль/л соответственно (дисперсионный анализ Краскела — Уоллиса, р = 0,001). Взаимосвязь уровня ТГ с индексом Кетле прямая, статистически значимая (rs = 0,43; p < 0,001). У пациентов с ИР уровень триглицеридов статистически значимо больше, чем у пациентов без ИР: 1,38 [1,04–2,04] и 0,88 [0,64–1,17] ммоль/л соответственно (критерий Манна — Уитни U = 358,0; р < 0,0001; коэффициент корреляции с индексом НОМА rs = 0,56; p < 0,0001).
По мере увеличения веса отмечено постепенное снижение липопротеидов высокой плотности (ЛПВП): в группе контроля — 1,86 [1,81–2,34] ммоль/л, при ИМТ— 1,38 [1,26–1,63] ммоль/л, при ожирении I степени — 1,27 [1,10–1,41] ммоль/л, II степени — 1,22 [1,06–1,49] ммоль/л и 1,12 [0,92–1,41] ммоль/л при III степени ожирения. Снижение антиатерогенной фракции более выражено у взрослых с диагностированной ИР.
Таким образом, изменения липидного спектра сыворотки крови у больных с ожирением отражают тенденцию к формированию атерогенной дислипидемии, особенно при наличии инсулинорезистентности.
Гиперурикемия. Гиперурикемия выявлена у 47,6 % подростков с лишним весом. Частота повышения уровня мочевой кислоты (МК) растет по мере увеличения веса (коэффициент частной корреляции с индексом Кетле rs=0,28; p = 0,0001). Так, при ИМТ гиперурикемия выявлена у 35,3 % пациентов, при ожирении I степени — у 33,3%, II степени — у 38,8 %, а при ожирении III степени— у 41,2 %, в то время как в группе контроля только 1 (5,5%) подросток имел уровень МК выше физиологической нормы. По данным литературы, гиперурикемия является одним из ранних признаков становления АГ и может способствовать ее прогрессированию. При анализе средних уровней МК в зависимости от уровня АД отмечен статистически значимый рост по мере прогрессирования АГ: 348,2 ± 95,0 мкмоль/л при «гипертонии белого халата» (ГБХ), 363,9 ± 74,0 мкмоль/л при лабильной АГ (ЛПГ) и 381,2 ± 93,5 мкмоль/л при стабильной АГ. Выявлены статистически значимые взаимосвязи между уровнем МК и средними цифрами как САД, так и ДАД в течение суток (rs = 0,29 и rs = 0,23 соответственно; p <0,05), а также нагрузкой давлением САД и ДАД (rs = 0,27 и rs=0,23 соответственно; p < 0,05).
Взаимосвязи уровня МК в сыворотке крови с индексом НОМА, описанные в литературе, не обнаружены, но отмечено отличие уровней МК в зависимости от типа распределения ПЖК. Наибольший уровень МК отмечен у подростков с равномерным распределением ПЖК: 384,5 [321,3–480,0] мкмоль/л, несколько ниже при абдоминальном типе распределения — 361,7 [310,0–432,0] мкмоль/л, самое низкое содержание наблюдалось при гиноидном типе — 321,0 [269,0–399,2] мкмоль/л.
У взрослых пациентов, напротив, при наличии ИР уровень МК в сыворотке крови значимо выше, чем у больных с отсутствием ИР: 330,5 [248,0–408,0] и 250,5 [225,0–324,3] мкмоль/л соответственно (критерий Манна — Уитни U = 639,0; р = 0,006). По типу ожирения наблюдаемые различия не являются статистически значимыми, но имеют тенденцию к повышению при висцеральном ожирении. Гиперурикемия документирована у 25,7 % взрослых больных с различной степенью избытка массы тела. Частота встречаемости гиперурикемии превалировала у больных с III степенью ожирения (40 %), в то время как при ожирении I и II степени гиперурикемия зарегистрирована в 23,3 и 24,1 % случаев соответственно. При незначительном избытке массы тела повышение МК встретилось в 2 раза реже (11,8 %). В группе контроля повышения МК выше допустимого уровня не выявлено. Отмечена достаточно высокая сопряженность уровня МК с индексом Кетле (rs = 0,41; p < 0,001).
Таким образом, гиперурикемию можно отнести как к маркерам формирования МС, так и к предикторам возникновения АГ. Возможно, гиперурикемия является одним из связующих звеньев между повышением массы тела и развитием АГ.
Гормональный дисбаланс. Морфофункциональные особенности жировой ткани позволяют рассматривать ее как крупный, активно функционирующий орган, выполняющий существенную роль в поддержании гомеостаза организма. Исследование уровня гормонов проводили только в когорте взрослых пациентов. Из современных теорий развития ожирения наибольшую популярность на сегодняшний день приобрела модель относительной лептиновой недостаточности, связанной с пострецепторной локализацией дефекта. В ходе исследования выявили значимое увеличение уровня лептина у всех пациентов с избыточной массой тела, причем чем выше степень ожирения, тем больше уровень лептина (rs = 0,46; p<0,0001). При ИМТ уровень гормона сытости в среднем в 2 раза превышает физиологическую норму — 26,8 [16,5–40,3]нг/мл, при ожирении I степени — более чем в 3 раза — 39,9 [28,3–53,7] нг/мл, при II степени — более чем в 4 раза — 45,8 [30,9–64,7] нг/мл), при ожирении III степени средний уровень гормона повышается почти в 5 раз — 51,9 [40,2–71,7] нг/мл. При анализе взаимосвязи уровня лептина с параметрами структуры тела выявлена прямая статистически значимая корреляция с количеством жировой ткани (rs = 0,38; p < 0,0001); при этом содержание зависит от типа распределения подкожно-жировой клетчатки: наименьший средний уровень гормона сытости отмечен у лиц с гиноидным типом распределения — 28,3 [16,7–65,1] нг/мл,в то время как при абдоминальном типе и равномерном ожирении средний уровень гормона значительно выше: 37,1 [24,2–50,5] нг/мл и 40,1 [26,6–55,7] нг/мл соответственно.
Интересным является факт зависимости уровня гормона сытости от давности ожирения: он выше у пациентов с большим стажем заболевания (rs = 0,43; p < 0,006). Можно сделать предположение о том, что высокие уровни гормона сытости не препятствуют ожирению. По данным проведенного исследования, у пациентов с ИР уровень лептина статистически значимо больше, чем у пациентов без ИР: 50,3 [37,1–69,8] нг/мл и 29,9 [18,8–45,5] нг/млсоответственно (критерий Манна — Уитни U = 875,5; р=0,00008; коэффициент корреляции с индексом НОМА rs = 0,46; p < 0,0001). По данным литературы, стимулирует экспрессию лептина инсулин, в то время как лептин снижает секрецию инсулина как через гипофагию, так и через угнетение вагальных влияний на поджелудочную железу, сдвигает баланс вегетативной нервной системы (ВНС) в сторону симпатической активности. Таким образом, повышение уровня лептина характерно для всех пациентов с лишним весом, но более значимо повышение у лиц с висцеральным ожирением и ИР. Возможно, гиперлептинемию можно отнести к одному из компонентов МС.
Одним из существенных факторов ожирения является ослабление соматотропной функции гипофиза, так как оно способствует гликемическим сдвигам, ослаблению липолитического и контринсулярного эффекта. Обнаружено, что при увеличении степени ожирения прогрессивно уменьшается уровень соматотропного гормона (СТГ), причем степень снижения зависит от избытка массы тела (rs=–0,34; р < 0,05) и длительности заболевания. Так, уровень СТГ в группе контроля составил 0,9 [0,5–1,6]мМЕ/мл,при ИМТ — 0,2 [0,1–1,5] мМЕ/мл, у пациентов с ожирением I степени — 1,0 [0,1–1,3] мМЕ/мл, при ожирении II и III степени — 0,1 [0,1–0,2] мМЕ/мл. При ожирении влияние возраста на уровень СТГ оказалось минимальным, больший вклад вносит степень и тип ожирения. Апостериорные межгрупповые различия отмечены между группой с равномерным и абдоминальным типом ожирения (Н = 0,013; р = 0,01). При абдоминальном типе уровень СТГ значимо ниже — 0,43 [0,36–0,48]мМЕ/л, в то время как при равномерном уровне распределения ПЖК— 1,29 [0,66–1,92] мМЕ/л.
Не выявлено значимых различий уровня кортизола в сыворотке крови в исследуемой когорте и статистически значимой взаимосвязи с индексом Кетле, типом распределения подкожно-жировой клетчатки, параметрами структуры тела и уровнем лептина. Не обнаружено существенных различий и в уровне тиреоидных гормонов у пациентов с различной степенью избытка массы тела и группы контроля.
Кардиоваскулярные аспекты ожирения
Большое внимание в современной медицине уделяется изучению патогенеза развития АГ в связи с высокой частотой инвалидности и смертности по причине ее осложнений. Причем отмечается пристальное внимание к данной проблеме со стороны как терапевтов, так и педиатров. Всем подросткам было проведено СМАД. Основанием для данного исследования явился поиск ответа на вопрос — прослеживается ли в анализируемой когорте зависимость уровня АД от степени выраженности избытка массы тела. По результатам исследования, среди подростков с лишним весом феномен ГБХ зарегистрирован в 26 % случаев, ЛАГ — в 34 %, а СтАГ — в 40 % случаев. По мере увеличения веса повышается частота встречаемости стабильной формы АГ. Так, у подростков с ИМТ стабильная форма АГ диагностирована в 33 % случаев, при ожирении I степени — в 37 %, II степени — в 40 %, а при III степени ожирения — в 76 % случаев. По данным литературы, стабильные формы АГ значительно чаще регистрируются у пациентов с инсулинорезистентностью, данный факт подтвержден в нашем исследовании: у подростков с ИР в 11 % случаев отмечается феномен «гипертонии белого халата», в 26 % — лабильная форма АГ, а в 63 % АГ носила стабильный характер.
По мере увеличения веса отмечается рост средних цифр систолического, среднего и пульсового АД. Коэффициент частной корреляции Спирмена между индексом Кетле и систолическим АД rs = 0,31; р < 0,00001. Согласно данным корреляционного анализа отмечается прямая значимая связь между индексом Кетле и САДсут (rs=0,39; р < 0,0001), ДАДсут (rs = 0,26; р < 0,0001) и средним АДсут (rs = 0,44; р < 0,0001). Полученные данные позволяют предположить, что индекс Кетле и АГ связаны патогенетически. То есть метаболические изменения, естественно возникающие на фоне избыточной массы тела, естественным образом ведут к повышению АД. Тяжесть АГ напрямую связана со степенью увеличения веса. Каждый лишний килограмм увеличивает систолическое АД на 0,36 мм рт.ст., диастолическое АД на 0,1 мм рт.ст.
В подростковом возрасте выраженное влияние на уровень АД оказывают вегетативный дисбаланс и психоэмоциональный стресс, что находит свое отражение в нарушениях циркадного профиля преимущественно систолического АД. Чем больше вес, тем более выражены колебания систолического АД в течение суток, и эти колебания не уменьшаются в период сна. Так, вариабельность систолического АД в течение суток в группе контроля составила 11,8 [10,4–13,0] мм рт.ст., у подростков с ИМТ — 13,1 [10,2–15,6] мм рт.ст., при ожирении I степени— 13,8 [12,0–15,3] мм рт.ст., II степени — 14,7 [13,0–15,9] мм рт.ст., а при ожирении III степени — 15,2 [13,5–15,8] мм рт.ст.
Изучение вегетативного гомеостаза у подростков с избыточной массой тела методом кардиоинтервалографии показало его неоднородность с преобладанием парасимпатической активности ВНС в спокойном состоянии пациента (53,6 %). При минимальной физической нагрузке отмечается активация симпатического отдела ВНС, которая сопровождается учащением частоты сердечных сокращений (ЧСС). Ваготония в состоянии покоя преобладала у подростков с нормальной чувствительностью клеток к инсулину (75 %), в то время как у больных с диаг-ностированной инсулинорезистентностью в 50 % случаев отмечена симпатико- и гиперсимпатикотония. Активацию симпатической нервной системы (СНС) можно рассматривать как адаптивный ответ на переедание, направленный на стабилизацию массы тела. Вегетативная реактивность имела разнонаправленный характер во всех группах наблюдения. Нормотонический вариант отмечен у 38,1 % подростков. Гиперсимпатикотонический вариант функционирования сердечно-сосудистой системы при переходе в вертикальное положение был зарегистрирован у 42,9 % подростков с лишним весом, встречаемость данного типа увеличивалась по мере прогрессирования ожирения. При физической нагрузке вегетативное обеспечение явно нарушено, вагусные влияния выражены минимально. Преобладает избыточное вегетативное обеспечение деятельности с гиперсимпатикотонией на нагрузку.
Отмечена определенная роль катехоламинов в развитии этих нарушений. По мере увеличения веса диаг-ностировали увеличение уровня норадреналина в суточной моче. Так, в группе контроля уровень норадреналина составил 199,0 [135,6–410,0] нмоль/л, у подростков с ИМТ— 217,7 [180,4–296,9] нмоль/л, при ожирении Iстепени — 239,1 [151,9–454,5] нмоль/л, II степени— 245,6 [137,3–326,6] нмоль/л, а при ожирении III степени — 435,1 [176,4–485,5] нмоль/л. Известно, что норадреналин увеличивает метаболический термогенез, а это может отражаться на пищевом поведении, показывая несостоятельность центральных механизмов регуляции пищевого поведения при ожирении. Повышение уровня норадреналина у подростков с ожирением можно расценивать как адаптационную реакцию организма в ответ на избыточное накопление жировой ткани. Возможно, активация симпатического отдела ВНС представляет собой патофизиологический механизм, ведущий к развитию артериальной гипертензии, ассоциированной с ожирением. Ожирение в молодом возрасте скорее всего связано с активацией симпатической нервной системы, но не с ее супрессией.
При АГ, ассоциированной с ожирением, у подростков происходит структурно-геометрическая перестройка миокарда левого желудочка. Прежде всего увеличивается толщина стенок ЛЖ: задняя стенка и межжелудочковая перегородка.
Увеличение стенок ЛЖ формируется вначале как адаптивная реакция миокарда на нагрузку давлением и обеспечивает поддержание соответствия сократительной функции ЛЖ возросшей нагрузке. С увеличением веса повышается частота встречаемости гипертрофии миокарда левого желудочка: при ИМТ она наблюдается в 27,3% случаев, при ожирении I степени — в 33,3 % (из них в 7,7% — тяжелая ГЛЖ), II степени — в 42 % (из них в 9,5 %— тяжелая ГЛЖ), а при ожирении III степени более половины подростков (69,2 %) имели признаки ГЛЖ. Анализ ИММЛЖ в зависимости от варианта АГ существенных различий не обнаружил. По-видимому, избыток массы тела вносит больший вклад в развитие гипертрофии ЛЖ.
Функционирование левого желудочка напрямую связано с геометрией левого предсердия (ЛП). Разница в средних значениях размеров ЛП выявлена между всеми группами наблюдения (критерий Краскела — Уоллиса Н= 1,0; р = 0,04).
Избыточная масса тела, по результатам многих исследований у взрослых, вносит значимый вклад в изменения миокарда и сосудистого русла. Для АГ характерна перестройка геометрии левого желудочка, которая выявлена у 47,2 % подростков с избыточной массой тела. Эксцентрическая гипертрофия миокарда ЛЖ больше характерна для «объем-зависимой» АГ, данный тип патологической геометрии превалирует во всех группах наблюдения (18%). Он связан преимущественно с увеличением объема циркулирующей крови (ОЦК), который отмечается при ожирении и увеличении поваренной соли в рационе пациента. Последний факт широко распространен в изучаемых нами группах. Косвенно об ОЦК можно судить по минутному объему кровообращения, который постепенно возрастает по мере прогрессирования степени ожирения. Эксцентрическая гипертрофия ЛЖ у взрослых характерна для длительно протекающей АГ, в подростковом возрасте это, по-видимому, связано с физиологическими особенностями растущего организма. Концентрическое ремоделирование больше характерно для АГ, в генезе которой основную роль играют вазоспастические реакции,— оно встретилось у 9,3% пациентов с лишним весом. На высокий риск сердечно-сосудистых катастроф указывает наличие концентрической гипертрофии ЛЖ, которая зарегистрирована у 4,4 % подростков с ожирением.
Таким образом, структурная адаптация сердца и избыточной массы тела проявляется дилатацией полости ЛП и умеренным утолщением миокарда. Результаты исследований свидетельствуют о том, что ожирение, ассоциированное с повышением АД, вносит значимый вклад в развитие ремоделирования миокарда левых отделов сердца.
Осложнения АГ нетипичны для детского возраста, однако функциональные изменения в органах-мишенях начинаются уже на ранних этапах формирования заболевания. Пристальное внимание кардиологов в последнее время привлечено к органам-мишеням, которые чаще всего подвержены влиянию высокого АД: головному мозгу, сердцу, почкам, микроциркуляторному руслу. Проведен анализ маркеров эндотелиальной дисфункции. В ходе исследования выявлено прогрессивное увеличение фактора Виллебранда у подростков с артериальной гипертензией, ассоциированной с избыточной массой тела. Так, в группе контроля уровень фактора Виллебранда в сыворотке крови составил 81,0 [67,0–122,0] %, у подростков с ИМТ— 89,0 [77,0–130,0] %, у пациентов с I степенью ожирения— 100 [77,0–131,0] %, со II степенью — 97,5 [72,0–125,0] %, а при III степени ожирения — 116,0 [85,0–139,0] %. Аналогичные изменения были выявлены и в содержании фибриногена в сыворотке крови: в группе контроля — 2,8 [2,5–2,9] г/л, у подростков с ИМТ — 3,2 [2,8–4,4] г/л, у пациентов с I степенью ожирения — 2,9 [2,5–3,6] г/л, со II степенью — 3,6 [3,6–4,2] г/л, а при III степени ожирения — 3,6 [3,2–4,1] г/л. Данный показатель также является маркером дисфункции эндотелия и в большей степени связан с наличием АГ. Еще одним вазоконстриктором, роль которого в возникновении дисфункции эндотелия признана, является кортизол. Существенных различий между группами наблюдений и группой контроля мы не выявили, но средние цифры повышены практически у всех подростков. Интересные взаимосвязи обнаружены с индексом НОМА (rs = 0,43; р <0,05), при этом уровень кортизола при ИР составил 1107,8 ± 477,8нмоль/л, в то время как при индексе НОМА менее 2,77 уровень кортизола почти 2 раза меньше— 638,7 ± 170,5 нмоль/л.
Одним из ведущих признаков поражения органов-мишеней на фоне повышения АД является ангиопатия по гипертоническому типу, которая выявлена в 60,5 % случаев. При II и III степени ожирения данный тип превалирует (66,0 и 71,4 % соответственно). Подобные изменения микроциркуляторного русла затрагивают сосуды не только глазного дна, но и всех органов и систем, что сопровождается нарушением обменных процессов.
При анализе МРТ головного мозга нормальная картина отмечена лишь у 11,3 % подростков с избыточной массой тела. В остальных случаях по данным МРТ были выявлены те или иные отклонения. Наиболее часто наблюдалась гипертензивная энцефалопатия (37,1 %), которая выражалась в виде перивентрикулярного отека или лейкоареоза, расширения борозд и дифференциации серого и белого вещества; перивентрикулярная отечность незначительная и преимущественно вокруг передних рогов боковых желудочков. Мелкофокальные очаги повреждения головного мозга отмечены у 17,7 % тучных подростков. Обращает на себя внимание высокая частота встречаемости кист задней черепной ямки (19,4 %), которые могут носить посттравматический характер. Среди пациентов молодого возраста с лишним весом и АГ внутричерепная гипертензия встречается в 67,8 % случаев (из них 57,4 % приходится на минимальную ВЧГ и 42,6% — на умеренную). Степень выраженности ВЧГ взаимосвязана со средним САД в дневное время (rs = 0,22; р < 0,05). Таким образом, при избыточной массе тела отмечаются структурные изменения головного мозга с высокой частотой внутричерепной гипертензии. Влияние изменений головного мозга на возникновение и прогрессирование ожирения требует дальнейшего тщательного изучения.
Среди взрослых пациентов с лишним весом гипертоническая болезнь диагностирована более чем у половины: в группе с избыточной массой тела ГБ отмечена у 33% пациентов, среди больных с ожирением I степени— у 53%, при II степени ожирения — у 57 %, а при III степени— у 79%. Высокий процент встречаемости подтверждает то, что АГ является одним из наиболее частых осложнений ожирения. АГ статистически значимо взаимосвязана с избытком как жировой, так и безжировой массы (U=5367,0; р = 0,0003 и U = 5616,5; р < 0,0001 соответственно) и чаще встречается при андроидном типе распределения ПЖК (66,7 %).
Анализ взаимосвязи ИР с наличием или отсутствием зарегистрированного диагноза ГБ у пациентов с избыточной массой тела продемонстрировал, что при наличии ИР частота встречаемости ГБ выше — 65 %, в то время как у пациентов с нормальной чувствительностью клеток к инсулину частота ГБ составила 38 % (р = 0,02).
В патогенезе АГ, возможно, играет роль и повышение уровня лептина. Гипертензивное действие лептина прежде всего связано с избыточной стимуляцией симпатического отдела периферической нервной системы. В исследовании показано, что у пациентов с АГ содержание лептина выше, чем у нормотензивных лиц: 47,0 [34,3–66,4]нг/мл и 28,7 [18,9–49,3] нг/мл соответственно (критерий Манна — Уитни; U = 687,5; р = 0,001).
У взрослых пациентов с ГБ более часто начало ожирения отмечалось в детском и подростковом возрасте. Таким образом, мы можем предположить, что вероятность развития ГБ тем выше, чем раньше началась активная прибавка веса.
Динамика метаболического дисбаланса и артериальной гипертензии в молодом возрасте
Большой интерес представляет проблема связи ожирения у пациентов подросткового возраста с ожирением у тех же пациентов, ставших взрослыми. Обследовано 58 человек (37 юношей и 21 девушка) через 5 лет после первичного обращения с жалобами на повышение АД, ассоциированное с ожирением. После проведенного обследования родители и подростки получили исчерпывающую информацию о необходимости изменения традиций питания в семье и консультаций с психотерапевтом. Отмечены низкая приверженность родителей к полученным рекомендациям, нежелание менять устоявшиеся стереотипы жизни. Наблюдение за подростками с АГ проводилось в декретированные сроки, согласно национальным рекомендациям. Через 5 лет было проведено повторное обследование. В 12,1% случаев не отмечено существенного увеличения индекса Кетле (изменения в пределах 2 пунктов), у более чем половины пациентов снизился вес (55,2%). Треть пациентов (32,7 %), по данным 5-летнего проспективного наблюдения, существенно прибавили в весе. Усугубление варианта АГ зарегистрировано у 32,8% молодых людей: переход ГБХ в лабильную или стабильную форму АГ, переход ЛАГ в СтАГ, прогрессирование степени тяжести СтАГ— повышение индекса нагрузки давлением не менее чем на 20 % и/или появление поражения органов-мишеней. Переход в более легкую форму АГ отмечен у 44,8% пациентов, сохранение прежней клинической картины — у 22,4 %. По совокупности изменений молодые люди, обследованные в катамнезе, были условно разделены на 3 группы: 1-я группа — пациенты с явным клиническим улучшением (уменьшение индекса Кетле не менее чем на 2 пункта, отсутствие основных маркеров метаболического синдрома) — положительная динамика (32 человека); 2-я группа — пациенты без существенных изменений веса (увеличение веса пропорционально росту, незначительные изменения в уровне показателей — маркеров МС)— без динамики (6 человек); 3-я группа— пациенты с ухудшением (повышение массы тела, развитие МС) — отрицательная динамика (20 человек).
Изменение средних цифр офисного АД и средних цифр по результатам СМАД свидетельствует о том, что при снижении веса отмечается уменьшение средних цифр систолического АД.
В то же время при сохранении прежней степени ожирения или его усугублении отмечается рост САД, причем более значительный — у пациентов с сохранением прежней степени ожирения. При сохранении прежнего веса нагрузка давлением в среднем увеличилась почти в 2 раза днем и в 3 раза ночью. Средние цифры диастолического АД с возрастом снижаются у всех пациентов независимо от динамики массы тела. Вероятно, с окончанием пубертата уменьшается влияние симпатического отдела ВНС и происходит расширение сосудов микроциркуляторного русла. Это обстоятельство косвенно доказывает и снижение с возрастом средних цифр ЧСС независимо от группы наблюдения.
Динамика средних цифр АД находит свое отражение и в изменениях суточного профиля артериального давления. У молодых людей с уменьшением веса отмечается улучшение циркадного профиля систолического АД с преобладанием нормальной степени ночного снижения (dipper) САД — 54,6 %. При сохранении прежнего веса в большинстве случаев (25 %) циркадный профиль изменен в сторону неадекватного повышения САД и ДАД в период сна (night-pеаker), что является значимым фактором риска возникновения цереброваскулярных катастроф в молодом возрасте. При увеличении веса 50 % пациентов имеют недостаточное снижение САД ночью (non-dipper), что также неблагоприятно влияет на поражение органов-мишеней.
У молодых людей с уменьшением веса средние цифры ИММЛЖ значительно уменьшаются. Если ожирение сохраняется и прогрессирует, миокард левого желудочка прогрессивно утолщается, что находит свое отражение в увеличении ИММЛЖ.
При исследовании отдельных биохимических маркеров метаболического синдрома значимой разницы между группами наблюдения не выявлено. С возрастом отмечается тенденция к снижению уровня мочевой кислоты при любой динамике веса. При увеличении массы тела зарегистрирован рост уровня триглицеридов в сыворотке крови с 1,6 [1,2–2,1] до 2,0 [1,7–2,7] ммоль/л, что патогенетически связано с ожирением.
Гипотензивную терапию получали 26 пациентов, в 26,9% случаев (7 человек) мы не выявили существенного изменения уровня АД и в 38,5 % (10 больных) отмечали отрицательную динамику с прогрессированием АГ. В то же время назначение немедикаментозных методов коррекции с курсами кардиометаболической терапии 15 пациентам у 9 (60 %) из них привело к положительной динамике без использования гипотензивных средств. Вероятно, немедикаментозная терапия должна быть приоритетной в подростковом возрасте, так как АГ, ассоциированная с ожирением, чаще носит нейрогенный характер.
Изменение структуры тела в период набора и снижения веса
С помощью импедансометрии провели исследование структуры тела взрослых пациентов. По результатам анализа выявлено увеличение массы жировой и безжировой составляющей у пациентов с ожирением в соотношении 10 : 2 (по данным литературы — 8 : 2) независимо от пола. На каждый процент избыточной безжировой массы приходится 5 % избытка массы жировой ткани.
Частью безжировой массы является активная клеточная масса (АКМ) — общий вес клеток мышц, внутренних органов, нервной ткани и т.д., то есть все клетки, в которых происходят метаболические процессы. По весу около 80 % всех клеток АКМ составляют мышцы. В процессе снижения веса именно активная клеточная масса берет на себя функцию сжигания жира. Отмечено снижение относительного количества АКМ по мере увеличения веса. На основании этого можно сделать предположение о снижении метаболической активности организма человека при ожирении. Уменьшение удельного веса метаболически активных тканей вызывает чувство постоянного голода, несмотря на большое количество энергетических запасов в организме. Вероятно, поэтому полные люди испытывают чувство голода в большей степени, чем лица нормостенической конституции.
Уровень основного обмена во всех группах наблюдения значительно выше нормы (гамма-корреляция основного обмена с ростом ожирения 0,95; р < 0,005). Согласно уравнению простой линейной регрессии каждый избыточный килограмм массы тела добавляет примерно 11,1±0,5 ккал к основному обмену.
Отмечено увеличение количества общей воды у взрослых пациентов с избыточной массой тела в среднем до 41,6 ± 7,6 л (норма 27–32 л) и общей жидкости (вода, находящаяся в несвязанном состоянии) до 35,6 ± 5,2 л.
Тем не менее по мере прогрессирования ожирения отмечается выраженное снижение относительного количества несвязанной воды в организме. В жировой ткани содержится значительно меньше воды, чем в мышцах, что обусловливает развитие относительного обезвоживания у лиц с крайними степенями ожирения.
Каждый лишний килограмм безжировой массы добавляет 700,0 ± 30,0 мл к общей воде. Существенно меньше воды приходится на каждый лишний килограмм жировой ткани — +60,0 ± 2,0 мл к общей воде (стандартизованный коэффициент 0,098). Таким образом, при ожирении мы говорим о формировании относительного обезвоживания при абсолютном увеличении воды в организме тучного пациента. Тип обезвоживания при незначительном избытке массы тела чаще внутриклеточный, в то время как при высоких степенях ожирения — внеклеточный. У пациентов с ИМТ внутриклеточный тип обезвоживания отмечен в 58 % случаев, у больных с I степенью ожирения превалирует внеклеточное обезвоживание (51 %), при ожирении II и III степени данный тип встречается в 61 и 59 % случаев соответственно. Этот факт необходимо учитывать при составлении программы реабилитации и лечения пациентов с ожирением.
Все взрослые пациенты проходили комплексную программу снижения веса, которая включала групповую психотерапию (25 часов с использованием методов рациональной и телесноориентированной психотерапии), рефлексотерапию, составление индивидуальных планов питания с уменьшением калорийности до 50 % от должного. Контрольные встречи с проведением антропометрии, исследованием состава тела проводились через 2 недели от начала программы, через 1, 3 месяца и через год.
Рекомендации по изменению питания и образа жизни были разработаны на основании тщательного анализа отечественной и зарубежной литературы по вопросам лечения ожирения и ассоциированных с ним заболеваний, изучения существующих диет, их практической выполнимости и эффективности и клинического опыта наблюдения за пациентами, снижающими вес. Большое внимание было уделено субъективной переносимости программы снижения веса со стороны пациента: отсутствие чувства постоянного голода, страха «запрещенных» продуктов, видимые результаты с первого дня лечения.
Первые недели соблюдения рекомендаций по снижению веса характеризуются интенсивным его снижением (2 % исходной массы тела за 2 недели), 40 % которого приходится на жировую ткань, а 60 % — за счет снижения безжировой массы. Резкое уменьшение веса в первые дни программы объясняется активным выведением из организма жидкости и использованием в это время безазотистых, а именно углеводных запасов, в частности гликогена печени. После частичного использования углеводных запасов интенсивность потери веса значительно уменьшается, организм начинает расходовать легкодоступные белки скелетных мышц. Происходит снижение относительного количества активной клеточной массы, которая отвечает за все метаболические процессы в организме человека. За первый месяц лечения в среднем отметили снижение веса на 9%, причем из них 3,8 % за счет жировой ткани. В этот период активно происходит потеря безжировой массы, темпы выведения воды значительно уменьшаются. Восстановление активной клеточной массы происходит в среднем через месяц от начала терапии, при условии обязательного включения животного белка в рацион в дозе не менее 1–1,5 г/кг. Через 2–3 месяца редукционного питания наступает переломная фаза, которая может длиться до нескольких месяцев. Эта фаза характеризуется перестройкой механизмов регуляции жировой ткани. Данный этап — самый сложный для пациента: возвращается голод, тормозится снижение веса, замедляется основной обмен веществ. Темпы снижения веса резко уменьшаются. Так проявляется защитная реакция организма, направленная на сохранение запасов энергии. Однако в этот период потеря веса идет за счет редукции жировой ткани. Отмечается прирост безжировой массы, что обусловлено нормализацией рациона питания и правильным соотношением нутриентов, несмотря на ограничение калорийности питания.
Одним из важных моментов при подборе терапии является изучение водных секторов в процессе снижения веса. Первые 2 недели характеризуются резким снижением относительного количества общей воды с 43,3 до 42,5%, потеря веса происходит за счет потери жидкости. В дальнейшем относительное количество общей воды неуклонно растет, достигая 45 % через 1 месяц терапии и 49% через год. Это обусловлено тем, что конечными продуктами распада триглицеридов жировой ткани являются углекислый газ и вода. Структура жировой ткани при объективном осмотре становится мягкой, с пастозностью подкожно-жировой ткани. Это обусловлено как повышением образования эндогенной воды в ходе катаболизма, так и дисбалансом электролитов в клетках и межклеточном пространстве и комплексным влиянием нарушенной гормональной секреции.
При снижении веса в организме запускается каскад биохимических реакций, связанных с разрушением жировой ткани и высвобождением в кровь огромного количества токсических веществ. За счет этого отмечается перераспределение жидкой части из внутриклеточного в интерстициальное пространство в первый месяц снижения веса. Можно предположить, что этот показатель отражает начало апоптоза жировых клеток. Несмотря на значительное повышение относительного содержания воды, соотношение внутри- и внеклеточной жидкости приходит к исходным величинам уже к третьему месяцу терапии.
Интересные данные получены при анализе изменения структуры тела через 1 год терапии. На каждый сброшенный килограмм жировой ткани приходится 0,75кг уменьшения безжировой массы и 0,25 л общей воды. Таким образом, снижение веса происходит за счет уменьшения жировой, безжировой массы и общей воды в соотношении 1 : 3/4 : 1/4. За год наиболее типично снижение веса на 8,7–18,6 % от исходного уровня. Уменьшение веса статистически значимо коррелирует с индексом Кетле — каждая единица индекса Кетле соответствует увеличению среднего количества сброшенных килограммов на 0,93. Большинство наших больных ставили перед собой задачу снизить вес до 62–75 кг. За критерий успешности снижения веса в исследовании принимали снижение массы тела не менее чем на 10 % от исходного уровня либо достижение идеальной массы тела, рассчитанной по индексу Брока. С данной точки зрения более 50 % больных достигли цели, причем достижение результата не зависело от степени ожирения. С целью прогнозирования успешности лечения проведен анализ между снижением массы тела и основными маркерами метаболического синдрома и гормональными показателями. При наличии ИР и таких маркеров МС, как атерогенные изменения липидного профиля сыворотки крови, гиперурикемия и гиперлептинемия, снижение веса менее эффективно. Не выявлено взаимосвязей между параметрами структуры тела и успешностью в достижении результата. Таким образом, можно сделать вывод о том, что у пациентов с метаболическим синдромом и высоким уровнем лептина вес снижается значительно хуже. Возможно, в этом случае необходимо дополнительно прибегать к медикаментозной терапии.
По данным исследования, тучные люди способны выполнять рекомендации по ограничению коридора калорийности в диапазоне от 3 до 6 месяцев. Критическими периодами являются 3-й и 6–7-й месяцы терапии. Среди причин срыва на первый план выходит лень (22 % случаев) и внешние обстоятельства: праздники (10 %), отпуск (7 %), усталость (5 %), стресс (11 %) и болезнь (6 %). Пятая часть пациентов прекращает программу по причине достижения поставленной перед собой цели, и еще 7 % продолжают лечение через год от начала терапии.
По данным литературы, 90–95 % пациентов восстанавливают исходную массу тела в течение 6 месяцев после окончания курса диетотерапии. По данным проведенного анализа, испытуемые, которые перестали соблюдать рекомендации, к концу первого года в среднем прибавили 3 [1–6] кг (3,4 % от достигнутой массы тела), что по сравнению со средним снижением веса (12 кг) тем не менее оказывает положительный эффект на состояние здоровья. Увеличение массы тела значимо связано с причиной срыва (rs=0,0019; p <0,05). Статистически значимо больше килограммов набирают те пациенты, причиной срыва у которых были лень, отпуск или стресс. Увеличение массы тела выше у пациентов с большим процентным содержанием жировой ткани (rs =0,30; p <0,05). Причина восстановления массы тела у тучных больных может быть объяснена в рамках липопротеинлипазной гипотезы: при ожирении повышается активность фермента липопротеинлипазы, который высвобождает свободные жирные кислоты из липопротеинов сыворотки крови.
Как один из вариантов поддержки была разработана методика дистанционного сопровождения пациентов, которая включает в себя консультативную помощь по вопросам питания, здоровья, программы реабилитации и психологическую поддержку, осуществляемую через Интернет. В рамках помощи пациентам создан информационный ресурс на сайте www.fatnet.ru. Курсанты имеют возможность в любое время обратиться за помощью или консультацией к своему врачу, получить психологическую помощь со стороны как профессионального психотерапевта, так и других пациентов, участвующих в программе. Такая форма работы удобна для пациентов и врачей, так как она экономична и не требует больших временных затрат.
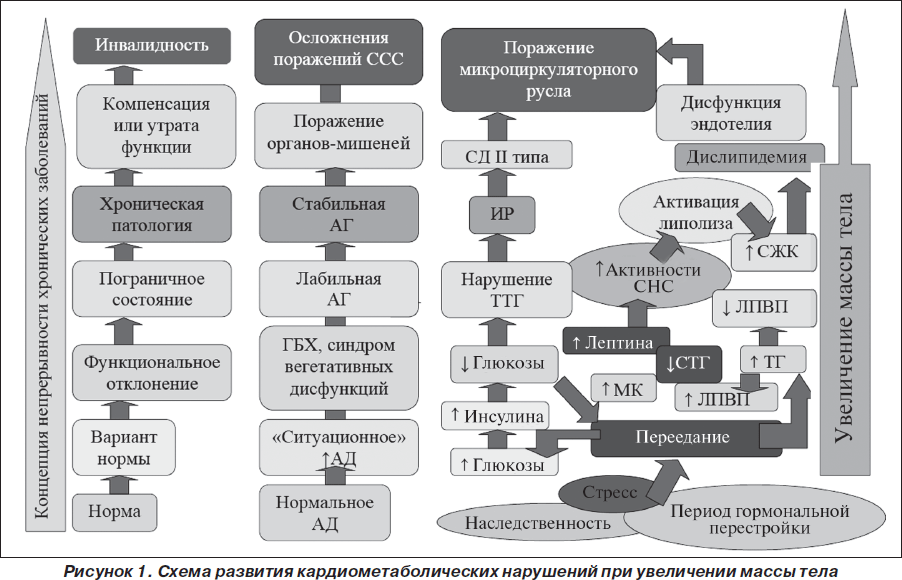
Таким образом, ожирение можно отнести к хроническим заболеваниям с полиорганными поражениями и частыми рецидивами. Рассматривая ожирение с точки зрения концепции непрерывности развития всех хронических заболеваний, от нормы до хронической патологии и осложнений через стадии функциональных отклонений и пограничных состояний, следует учитывать, что для развития полной стадийности заболевания необходимо определенное время. Поэтому клиническая картина ожирения в большей степени зависит от стажа заболевания, чем от его степени. Концепция непрерывности развития артериальной гипертензии и метаболического синдрома отражена на рис. 1.
Как мы видим, ожирение и сердечно-сосудистые заболевания имеют массу точек соприкосновения уже на стадии риска развития заболеваний. Они неразрывно связаны между собой, и наиболее целесообразно рассматривать данные патологии в единой концепции. Диагностику маркеров МС и лечебно-профилактические мероприятия актуально проводить в детском и подростковом возрасте, когда происходит формирование всех основных органов и систем, становление пищевых пристрастий и приверженность к определенному образу жизни, а заболевания носят функциональный характер, без грубой органической патологии. Основные рекомендации для пациентов с лишним весом и ассоциированными с ним заболеваниями должны быть направлены на изменение образа жизни, в том числе и питания. Лечение пациентов необходимо начинать как можно раньше, до того как сформируются основные привычки питания и образа жизни.
Выводы
1. Метаболический дисбаланс у подростков с избыточной массой тела характеризуется развитием атерогенной дислипидемии, гиперурикемии, инсулинорезистентности. Для развития метаболического синдрома в молодом возрасте опасен любой избыток жировой ткани независимо от типа ее распределения.
2. Частота встречаемости стабильной АГ растет по мере прогрессирования ожирения (при избыточной массе тела составила 33 %, при ожирении I степени — 37 %, II степени — 40 %, а при III степени — 76 %). Циркадный профиль АД у подростков с избыточной массой тела характеризуется повышением вариабельности преимущественно систолического АД и отсутствием его адекватного снижения в период сна. Каждый лишний килограмм массы тела приводит к увеличению систолического АД на 0,36 мм рт.ст., а диастолического — на 0,1 мм рт.ст. Вегетативный гомеостаз неоднороден, с преобладанием парасимпатической активности ВНС в покое и выраженной активацией симпатического отдела на минимальную нагрузку.
3. По данным проспективного 5-летнего наблюдения за подростками с артериальной гипертензией, ассоциированной с избыточной массой тела, в 55,2 % случаев отмечается положительная динамика со снижением веса, артериального давления и нормализацией метаболического профиля. Развитие метаболического синдрома отмечено у 44,8 % пациентов. Маркерами развития метаболического синдрома в молодом возрасте являются высокие уровни систолического АД, гипертриглицеридемия, гиперурикемия и снижение глюкозы натощак в период пубертата.
4. Развитие ожирения у взрослых происходит за счет увеличения массы жировых и безжировых тканей в отношении 10 : 2, сопровождается снижением относительной массы метаболически активных тканей, формированием относительного обезвоживания с преобладанием внеклеточного типа при высоких степенях ожирения.
5. Увеличение жировой массы у взрослых приводит к гормональному дисбалансу, который характеризуется повышением уровня лептина и снижением — соматотропного гормона пропорционально степени ожирения, эти изменения более выражены при висцеральном типе ожирения и инсулинорезистентности.
6. Частота встречаемости артериальной гипертензии у взрослых пациентов с ожирением составила 48,6 %. При сопоставлении с анализом состава тела АГ связана с избытком как жировой, так и безжировой массы и развитием относительного обезвоживания. Более частая встречаемость отмечалась у пациентов с андроидным типом ожирения (66,7 %) и инсулинорезистентностью (64,9%), значительно более редкая — при гиноидном типе (26,8%) и нормальной чувствительности клеток к инсулину (35,1%).
7. Нормализация массы тела отмечается у 20 % взрослых больных, 50 % добиваются снижения веса не менее чем на 10 % от исходного. Основной причиной срыва является нежелание соблюдать рекомендации. Метаболический синдром и выраженная гиперлептинемия уменьшают шансы успешного снижения веса на фоне немедикаментозного лечения.
1. Ryden L., Standl E., Bartnik M. et al. Guidelines on diabetes, pre-diabetes, and cardiovascular diseases: executive summary. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and of the European Association for the Study of Diabetes (EASD) // Eur. Heart. J. — 2007. — Vol. 28, №1. — P. 88-136.
2. Matthaei S., Stumvoll M., Kellerer M., Haring H.U. Pathophysiology and pharmacological basis of insulin resistanse // Endocr. Rev. — 2000. — Vol. 21, № 6. — P. 585-618.
3. Reaven G.M., Abbasi F., McLaughlin T. Obesity, insulin resistance, and cardiovascular disease // Recent Progress in Hormone Research. — 2004. — Vol. 2, № 1. — P. 207-223.
4. Savage D.B., O’Rahilly S. Leptin therapy in lipodystrophy // Diabetologia. — 2010. — Vol. 53, № 1. — P. 7-9.
5. Sader S., Nian M., Liu P. Leptin: a novel link between obesity, diabetes, cardiovascular risk, and ventricular hypertrophy // Circulation. – 2003. – Vol. 108, №6. – P. 644-646.