Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Стартовая эмпирическая терапия пневмонии у детей: опыт применения Цефодокса
Авторы: Сенаторова А.С., Логвинова О.Л., Харьковский национальный медицинский университет, Басюк М.А., Башкирова Н.В., Крыжановская Е.Н., Харьковская областная детская клиническая больница
Рубрики: Педиатрия/Неонатология
Версия для печати
Пневмония занимает одно из ведущих мест в структуре заболеваемости детей. Ведущими факторами в выборе антибактериального препарата при назначении лечения пациенту с пневмонией являются специфика высеваемой флоры и ее чувствительность к антибиотикам.
В статье представлены результаты исследования эффективности и переносимости препарата Цефодокс у детей in vivo. Сделан вывод о целесообразности применения Цефодокса в лечении пневмонии у детей.
Пневмония, дети, Цефодокс, лечение.
В структуре заболеваемости детей одно из ведущих мест занимает пневмония. Ежегодно в мире регистрируется около 155 миллионов случаев заболевания пневмонией, что составляет 15–20 случаев на 1000 детей первых трех лет жизни и 5–6 на 1000 детей старше 3 лет. Неуклонный рост заболеваемости в течение последних 2 лет, вероятно, является результатом цикличности активации возбудителей пневмонии и трасформации чувствительности к антибиотикам флоры респираторного тракта.
Учитывая рост заболеваемости пневмонией, педиатру важно своевременно и рационально назначить антибактериальную терапию для предупреждения формирования резистентных форм возбудителя. Необходимо определить программу антибактериальной терапии пневмонии, что означает выбор антибиотика первого ряда, его суточной дозы, способа применения и кратности введения препарата. Этиотропное лечение любого заболевания предусматривает, прежде всего, знание возбудителя и его чувствительности к антибиотикам. Если у больного острая форма заболевания, врач не может откладывать начало лечения до выяснения этих вопросов, его эмпирические назначения должны проводиться с учетом вероятности того или иного возбудителя и его чувствительности. Работами последних лет показано, что точность эмпирического выбора противомикробного препарата может быть весьма высокой (80–70 %) [1]. Наиболее частым бактериальным возбудителем внебольничных пневмоний является Streptococcus pneumoniae: грамположительный диплококк, который вызывает очаговую либо долевую пневмонию в 70–80 % случаев. Второе место среди возбудителей пневмонии занимает Н.influenzae — грамотрицательная палочка, роль которой особенно велика в раннем детском возрасте. Она является причиной пневмоний в 15–20 % случаев. Mycoplasma pneumoniae вызывает пневмонию у 10–15 % населения. Преимущественно поражает детей преддошкольного и дошкольного возраста. Тенденция к повышению роли микоплазм в развитии пневмонии у детей этого возраста объясняется высокой частотой пребывания в организованных детских коллективах. В некоторых случаях инфицирование микоплазмой в коллективах достигает 30–50 %, а частота микоплазменных пневмоний составляет 25–30 % среди всех случаев острых пневмоний. Chlamydia pneumoniae вызывает около 10–30 % всех пневмоний в раннем детском возрасте. Klebsiela pneumonia (палочка Фридлендера), E.coli — грамотрицательные бактерии, которые вызывают развитие пневмонии у 3–8 % больных и чаще выявляются у пациентов с сопутствующим иммунодефицитом. Staphylococcus aureus — грамположительный кокк, обусловливает развитие пневмонии не более чем у 5 % детей с иммунодефицитным состоянием. Для установления возбудителя традиционно проводят бактериологическое исследование мокроты. Определение чувствительности микроорганизмов к антибиотикам позволяет выявить резистентные штаммы, а антибиотикограмма служит подспорьем клиницисту. Основным недостатком этого метода является его продолжительность во времени — результаты бактериологического исследования известны не ранее чем на 3–4-й день, поэтому выбор антибиотика первого ряда осуществляется эмпирически.
Для успешного эмпирического выбора антибиотика принципиальное значение имеет ориентация врача в эпидемиологической ситуации региона, включая сведения о наиболее частых возбудителях пневмоний и их антибиотикорезистентности. Также необходима правильная оценка спектра действия антибиотика, охватывающая вероятных возбудителей заболевания. Крайне важны знания о биодоступности, способности накопления в высоких концентрациях в тканях, эрадикации возбудителя, длительности периода выведения. Изменившиеся социально-экономические условия требуют и учета стоимости предполагаемого лечения.
Таким образом, рост заболеваемости пневмонией, специфика высеваемой флоры и ее чувствительность к антибиотикам являются ведущими факторами в выборе антибактериального препарата.
Начатые в 2008 году исследования спектра микрофлоры респираторного тракта и ее чувствительности на базе Харьковской областной клинической больницы были продолжены в 2009 году.
Исследование состояло из 3 этапов:
1. Выяснение спектра высеваемых возбудителей у детей, страдающих пневмонией.
2. Выяснение чувствительности флоры, высеваемой у детей с пневмонией, к антибиотикам in vitro.
3. Изучение терапевтической эффективности и переносимости препарата Цефодокс у детей in vivo.
Материалы и методы
Обследовано 192 ребенка в возрасте от 5 месяцев до 18 лет с диагнозом «пневмония», госпитализированных в пульмонологическое и инфекционно-боксированное отделения Харьковской областной детской клинической больницы в 2009 году. Всем детям проводилось бактериологическое исследование мокроты и исследование чувствительности к антибиотикам in vitro стандартным бактериологическим методом. Забор мокроты проводился микроаспиратором утром до кормления ребенка.
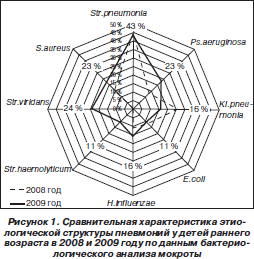
Данные анализа этиологической структуры пневмоний представлены на рис. 1. В 2009 году у детей достоверно чаще высевалась кокковая флора (Streptococcus pneumoniae, Staphylococcus aureus, Str. viridans, S.aureus), р < 0,05. Отмечен рост грамотрицательной флоры в пейзаже возбудителей пневмонии (р < 0,05), а также роль Н.influenzae в генезе данного заболевания (р < 0,05). E.coli преобладала у детей первых трех лет жизни, частота ее встречаемости достоверно не отличалась от регистрируемой в 2008 году (15 против 12 % в 2008 году; р > 0,05).
В пейзаже микрофлоры сохранялось ассоциированное существование микроорганизмов, которое отягощалось развитием перекрестной резистентности у возбудителей, составляющих «альянс», что значительно снижало возможности антибактериальной терапии. «Альянс» состоял из 2, 3, а иногда и 4 видов микроорганизмов. Обращало на себя внимание наличие условно-патогенной флоры.
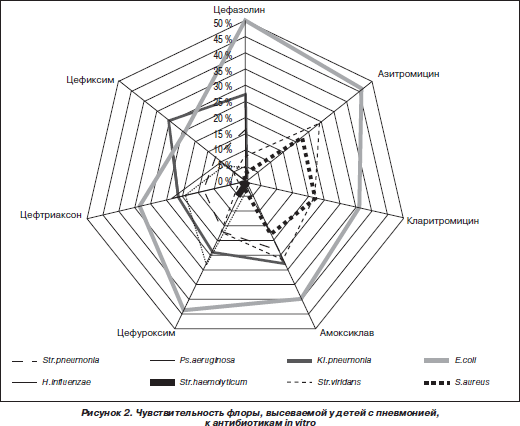
Вторым шагом в исследовании было определение чувствительности возбудителей к антибиотикам. Отмечено достоверное снижение чувствительности кокковых возбудителей по сравнению с 2008 годом к цефуроксиму — 44 % (в 2008 году — 88,0 %; р < 0,05), комбинации амоксициллина и клавулановой кислоты — 45 % (в 2008 году — 80,0 %; р < 0,05), что, вероятно, обусловлено широким применением этих препаратов педиатрами в 2009 году. К азитромицину чувствительность кокковой флоры достоверно не изменилась (46 % в 2009 году, против 50 % в 2008 году). Отмечено некоторое снижение резистентности пневмококка к цефазолину (задержка роста 46 % в 2009 году против 50 % в 2008 году).
Н.influenzae у детей с пневмонией была наиболее чувствительна к цефуроксиму (22 %). Несколько ниже определялась чувствительность к цефтриаксону и цефепиму. Выявлена высокая резистентность гемофильной палочки к цефазолину. Чувствительность к защищенным пенициллинам Н.influenzae оказалась достоверно ниже, чем у цефалоспоринов (р < 0,05).
Третий этап: клиническое исследование препарата Цефодокс проводилось у 30 детей в возрасте от 5 месяцев до 18 лет, больных пневмонией. Средний возраст пациентов — 36,5 ± 8,9 месяца. Важным является то, что Цефодокс содержит неактивное соединение, которое, всасываясь из желудочно-кишечного тракта, превращается в активный метаболит цефподоксим, который и поступает в очаг воспаления.
Выбор препарата Цефодокс обусловили несколько факторов:
— рост устойчивости возбудителей к цефалоспоринам I поколения;
— хорошая антибактериальная активность Цефодокса против основных возбудителей пневмонии;
— возможность перорального приема цефалоспорина ІІІ генерации, что очень важно в детском возрасте.
Отбор пациентов проводился по определенным критериям: в группу не входили дети с признаками недостаточности дыхания, с сердечно-сосудистой, почечной, печеночной недостаточностью, наличием внутригоспитальной или распространенной пневмонии, с некупируемой гипертермией, судорогами, тяжелой сопутствующей патологией, что обусловливает необходимость обязательной госпитализации больного и проведения парентеральной терапии.
Дети обращались в пульмонологический центр из районов Харьковской области, чаще на 2–3-й день заболевания. Диагноз бронхолегочной патологии устанавливался согласно критериям, приведенным в классификации наиболее распространенных бронхолегочных заболеваний у детей, принятой на ІІ съезде фтизиатров и пульмонологов Украины (Киев, 1998), и протоколам лечения (Киев, 2005). Детально изучались жалобы, анамнез больных, проводилось клиническое обследование и общепринятые лабораторные и инструментальные исследования для верификации диагноза.
Препарат Цефодокс назначался перорально в дозе 10 мг/кг/сутки в 2 приема. Дополнительные антибактериальные препараты не использовались. Продолжительность курса терапии составляла 5–7 дней. Спустя 12–14 дней после завершения лечения Цефодоксом был проведен финальный осмотр и рентгенография органов грудной клетки. Всем детям проводились общеклинические, лабораторные исследования крови, бактериологическое исследование мокроты, рентгенологическое исследование. Определялась динамика температуры тела, выраженности интоксикационного и респираторного синдромов, частоты дыхания, частоты сердечных сокращений. Определялась переносимость и безопасность терапии Цефодоксом по данным оценки побочного действия препарата.
Основными жалобами детей при поступлении в клинику были кашель (100 %), повышение температуры тела до фебрильных (40 %) или субфебрильных цифр (53 %), слабость (38 %), снижение аппетита (50 %), умеренное снижение массы тела (30 %).
В анамнезе жизни у всех обследованных детей были выявлены неспецифические факторы, снижающие общую резистентность организма ребенка: патологическое течение беременности у матери (70 %), раннее искусственное вскармливание (53 %), перенесенный на первом году жизни рахит (40 %), анемия (38 %), частые респираторные заболевания (56 %).
Основными клиническими симптомами были: бледность кожи (96 %), периорбитальные тени (43 %), физикальные изменения в легких в виде притупления легочного звука (100 %), наличие крепитации (43 %) и мелкопузырчатых хрипов (83 %).
При анализе лабораторного обследования было зарегистрировано: в клиническом анализе крови — лейкоцитоз (43 %) со сдвигом влево (96 %), повышение СОЭ (73 %). При проведении рентгенографии органов грудной клетки у всех детей определялись участки инфильтрации различной локализации.
Микрофлора мокроты у обследованных детей была представлена S.aureus (43 %), Str.pneumonia (36 %), Str.viridians (16 %), Kl.pneumonia (20 %), H.influenzae (13 %).
Эффективность лечения оценивалась по данным комплексного обследования через 3 дня лечения и в день окончания терапии.
На 3-и сутки терапии у 86 % детей нормализовалась температура тела, частота дыхания (86 %). У 43 % детей сохранялся редкий кашель. У 12 (40 %) пациентов кашель был частым и продуктивным. Физикальная картина также была с положительной динамикой: преобладали мелкопузырчатые влажные хрипы на фоне ослабленного дыхания (70 %). Крепитация сохранялась у 5 (16 %) больных. У двух (6 %) детей на 3-й день терапии отмечалось среднетяжелое состояние, обусловленное сохранением лихорадки, малопродуктивного кашля и отсутствием положительной физикальной динамики, что стало причиной исключения пациентов из исследования и смены антибиотика. Двое обследуемых (6 %) спустя 2 суток от начала лечения отказались от еды и питья, отмечалась рвота — терапия Цефодоксом была отменена.
Через 7 дней после начала лечения у большинства детей отмечалась положительная клиническая динамика течения болезни: уменьшились проявления интоксикационного синдрома, температура нормализовалась (86 %), повысился аппетит, дети стали более активными. Кашель отсутствовал у 73 % детей, у остальных пациентов он был редким (13 %). У 3 (10 %) детей на фоне лечения выявлены умеренные признаки диспепсии, однако самочувствие и состояние ребенка нарушено не было, что дало основание продолжить курс лечения.
Через 2 недели после окончания лечения отмечалось рассасывание инфильтрации у всех детей, получивших полный курс терапии препаратом Цефодокс, не было необходимости проведения повторного курса лечения антибактериальными препаратами.
Таким образом, препарат Цефодокс показал высокую эффективность и хорошую переносимость, что дает основание рекомендовать его использование в лечении пневмонии у детей.
Выводы
1. В последние годы регистрируется значительный рост заболеваемости детей пневмонией.
2. Отмечается тенденция к постоянному изменению чувствительности микрофлоры респираторного тракта к антибиотикам, что требует мониторинга этих показателей в пределах области, района, клиники и даже отделений клиники.
3. Применение Цефодокса может быть рекомендовано в комплексной терапии пациентов с пневмонией.
4. Цефодокс эффективен в монотерапии пневмонии у детей.
5. Цефодокс отличается удобством применения, хорошей переносимостью и безопасностью, что особенно важно для детей.
1. Практическая пульмонология детского возраста / В.К. Таточенко, С.В. Рачинский, И.К. Волков, А.М. Федоров / Под ред. В.К. Таточенко. — М.: Медицина, 2000. — 261 с.
2. Березняков И.Г. Резистентность к антимикробным препаратам: механизмы возникновения и клиническое значение. — Харьков, 2006. — 72 с.
3. Майданник В.Г. Клинические рекомендации по диагностике, лечению и профилактике заболеваний верхних дыхательных путей у детей. — К.: Аспект-Полиграф, 2003. — 177 с.
4. Волосовец А.П., Кривопустов С.П. Цефалоспорины в практике современной педиатрии. — Харьков: Прапор, 2007. — 183 с.
5. Мостовой Ю.М. Раціональна антибактеріальна терапія пневмоній. — 1998. — 32 с.
6. Окороков А.Н. Пульмонология // Диагностика болезней внутренних органов. — М.: Медицинская литература, 2000. — С. 1-54.
