Журнал «Здоровье ребенка» 5 (26) 2010
Вернуться к номеру
Вплив факторів зовнішнього середовища на фосфоліпідний спектр сироватки крові дітей, хворих на нефропатію
Авторы: Головачова В.О., Харківський національний медичний університет
Рубрики: Педиатрия/Неонатология
Версия для печати
Вивчено фосфоліпідний спектр сироватки крові дітей із патологією нирок, які мешкають у регіонах із різним рівнем забруднення оточуючого середовища. Проведене дослідження показало, що на показники дестабілізації клітинних мембран впливають не тільки активність запалення, залучення тубулоінтерстиціальної тканини в патологічний процес, але й несприятливі екологічні фактори оточуючого середовища.
Фосфоліпідний спектр крові, екологічні фактори, екологічні умовні кластери, нефропатія, діти.
Погіршення екологічної ситуації та соціально-економічного становища значної частини населення, стресові навантаження спричинюють прогресуюче погіршення показників захворювання дітей на нефропатії [3, 6]. Проблеми виявлення дітей із підвищеним ризиком для здоров’я та аналіз патології в екологічно нестабільних регіонах є одними з важливих у педіатрії [1, 2, 4, 5].
Певну роль у тяжкості перебігу та прогресуванні захворювань нирок відіграють структурно-функціональні порушення клітинних мембран [7]. Оскільки мембрани беруть участь у взаємодії клітини з середовищем, то при дії різних зовнішніх сигналів на клітину, у тому числі екологічних факторів, стимулюється обмін таких компонентів мембран, як гліцерофосфоліпіди (похідні фосфатидної кислоти — фосфатидилхолін, фосфатидилетаноламін, фосфатидилсерин, фосфатидилінозит) та сфінгофосфоліпіди, зокрема сфінгомієлін, що може призвести до мембранних порушень різного ступеня — від дестабілізації цитомембран до деструкції із загибеллю клітини [8, 9]. Таким чином, вивчення впливу факторів зовнішнього середовища на мембранні порушення в дітей із патологією нирок становить безумовний інтерес.
Мета дослідження — вивчити вплив факторів зовнішнього середовища на фосфоліпідний склад сироватки крові в дітей, хворих на нефропатію.
Матеріали та методи дослідження
Нами вивчений екологічний стан м. Харкова з урахуванням низки аероекологічних факторів, зокрема з розподілом дитячого населення за двома екологічними умовними кластерами (УК). Розподіл УК виконано з використанням інтегрального показника якості довкілля, рози вітрів та з використанням результатів прямих вимірів факторів довкілля (Хn) у зонах екологічного моніторингу (ZЕМ) Харківського обласного центру гідрометеорології. Для розподілу м. Харкова на екологічні УК використані дані динамічного (5 років) екологічного моніторингу довкілля в різних стаціонарних зонах контролю міста: Z9 — вул. 23 Серпня, 34; Z11 — провул. Театральний, 6; Z 12 — 605-й мікрорайон; Z13 — вул. Пащенківська, 4; Z16 — вул. Єлізарова, 4; Z17 — провул. Дерев’янка, Білгородське шосе; Z18 — пр. Героїв Сталінграда, 3; Z19 — Салтівське шосе, 120; Z21 — вул. Луначарського, 53; Z24 — вул. Академіка Павлова, 46.
Характеристика довкілля включала урахування факторів: Х1 — пил; Х2 — діоксид сірки; Х3 — сульфати; Х4 — оксид вуглецю; Х5 — діоксид азоту; Х6 — оксид азоту; Х7 — сірководень; Х8 — фенол; Х9 — сажа; Х10 — аміак; Х11 — формальдегід.
Ми розподілили м. Харків на два кластери: УКІ — із достатнім рівнем якості (Z11, Z16, Z17, Z21) та УКІІ — із низьким рівнем якості оточуючого середовища (Z9, Z12, Z13, Z18, Z19, Z24). В УКІ у 2009 році мешкало 96 057 дітей віком від 0 до 17 років включно, із них 8840 мали ураження сечостатевої системи, в УКІІ мешкало 104 746 дітей, із них 8646 — із захворюваннями сечостатевої системи.
Під спостереженням знаходилися 228 дітей віком від 1 до 18 років, які проживають у різних умовних кластерах, із яких 44 дитини хворі на гломерулонефрит (ГН), 21 — на інтерстиціальний нефрит (ІН), 54 — на дисметаболічну нефропатію (ДМН), 68 — на хронічний пієлонефрит (ПН) та 41 практично здорова дитина, які проживають в УКІ, які становили контрольну групу. 76 дітей були обстежені в динаміці захворювання: в активний період (1-й період) та в період зворотного розвитку чи ремісії (2-й період).
Верифікація діагнозів проводилася на основі ретельного клініко-лабораторного та інструментального обстеження хворих за загальноприйнятими методиками.
Визначення в крові фосфоліпідів як важливої складової клітинних мембран (загальних фосфоліпідів, лізофосфатидилхоліну, сфінгомієліну, фосфатидилхоліну, фосфатидилетаноламіну, фосфатидної кислоти, фосфатидилсерину, фосфатидилінозиту) проводили методом тонкошарової хроматографії [10].
При виконанні дослідження застосовано відомі та широковживані клініко-статистичні методи: варіаційна статистика, імовірнісний розподіл клінічних ознак з оцінкою вірогідності одержаних результатів [11, 12].
Результати та їх обговорення
Серед усіх обстежених дітей хлопчиків було 88 (47,1 %), дівчаток — 99 (52,9 %). У групі дітей, хворих на ГН, було більше дітей віком від 13 до 18 років, за статтю — хлопчиків. У групі дітей, хворих на ПН, відношення «хлопчики/дівчатка» залежало від вікової групи (зі збільшенням віку хворих збільшувався відсоток дівчаток). У групі хворих на ДМН переважали хлопчики.
У структурі ПН переважав вторинний пієлонефрит на фоні вроджених аномалій розвитку сечовивідної системи, міхурово-сечовідного рефлюксу, нейрогенної дисфункції сечового міхура, метаболічних порушень. Серед усіх обстежених, хворих на ПН, 31 дитина була хвора на обструктивний ПН, 37 дітей — на необструктивний ПН. При цьому 68 дітей, хворих на хронічний ПН, обстежені в активній стадії захворювання та 47 дітей — у динаміці, в неактивній стадії.
При обстеженні хворі на ГН були поділені на 2 групи: 1-шу групу становили діти, хворі на нефротичний синдром (НоС), нефротичний синдром із гематурією та/чи гіпертензією (НГГ) гострого ГН (ГГН), нефротичну (НоФ) та змішану форми хронічного ГН (ХГН), 2-гу групу — хворі на нефритичний (НиС) та ізольований сечовий синдроми (ІСС) ГГН, а також гематуричну форму (ГемФ) ХГН. Діти були обстежені у 2 періодах захворювання: 1-й період — початкові прояви ГГН або загострення ХГН; 2-й період — зворотний розвиток ГГН, часткова або повна ремісія ХГН.
Враховуючи однонаправленість змін показників фосфоліпідного спектра сироватки крові в дітей із різними варіантами (імунозапальні, мікробно-запальні, токсико-метаболічні, дисметаболічні) ураження нирок в активну фазу запалення чи зворотного його розвитку або ремісії, ми визнали можливим об’єднати їх в одну групу і проаналізувати особливості показників фракцій фосфоліпідів крові у цих хворих залежно від проживання в різних екологічних умовних кластерах.
Фосфоліпідний спектр сироватки крові у хворих на різні захворювання нирок, які мешкають у різних умовних кластерах, подано в табл. 1.
При ГГН та ХГН, незалежно від форми та активності захворювання, відзначаються зміни концентрацій усіх показників фосфоліпідного обміну, окрім вмісту сфінгомієліну, порівняно з показниками дітей групи контролю. Концентрація лізофосфатидилхоліну та фосфатидилсерину в сироватці крові значно вища в дітей, хворих на гострий та хронічний ГН в обох періодах, які мешкають в УКIІ, порівняно з показниками дітей, які мешкають в УКI. Уміст фосфатидилхоліну, фосфатидилінозиту та фосфатидилетаноламіну вірогідно (р < 0,02) підвищений у хворих у періоді початкових проявів гострого та загострення хронічного ГН, які проживають в УКIІ, порівняно з групою хворих, які мешкають в УКI. Також уміст усіх фракцій фосфоліпідного обміну, окрім рівня сфінгомієліну, вірогідно зменшується в періоді ремісії ГН порівняно з показниками дітей у періоді активності захворювання, незалежно від умов проживання.
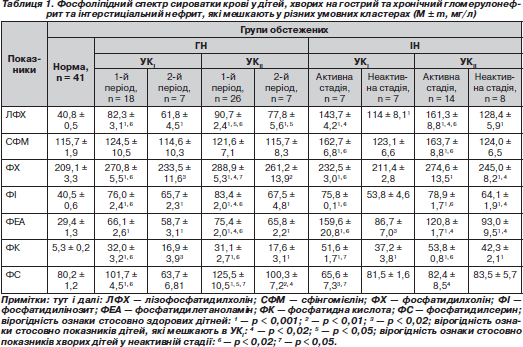
Вивчення показників фосфоліпідного спектра в дітей, хворих на гострий та хронічний ІН, які мешкають у різних умовних кластерах (табл. 1), засвідчило, що кількісний уміст майже всіх фракцій вірогідно змінений порівняно з показниками дітей групи контролю, за винятком вмісту сфінгомієліну, фосфатидилхоліну, фосфатидилінозиту та фосфатидилсерину у хворих у неактивній стадії, які мешкають в УКI, та вмісту сфінгомієліну та фосфатидилсерину в дітей у неактивній стадії захворювання, які проживають в УКІІ. Уміст лізофосфатидилхоліну, фосфатидилетаноламіну та фосфатидилсерину в сироватці крові в активній стадії ІН вірогідно нижчий (р < 0,05) у дітей, які мешкають в УКI, порівняно з показниками дітей, які проживають в УКII. Також уміст фосфатидилхоліну, фосфатидилінозиту та фосфатидилетаноламіну в дітей у неактивній стадії захворювання, які мешкають в УКI, вірогідно (р < 0,001) змінено порівняно з концентрацією цих показників у дітей, які проживають в УКII. Концентрація всіх фракцій фосфоліпідів зменшується, а фосфатидилсерину збільшується в неактивній стадії гострого та хронічного ІН порівняно із хворими в активній стадії захворювання.
Як видно з табл. 2, уміст усіх фракцій фосфоліпідного складу сироватки крові вірогідно змінено у хворих на ДМН та хронічний ПН, окрім рівня фосфатидилінозиту в дітей, хворих на хронічний ПН, незалежно від стадії захворювання, та вмісту лізофосфатидилхоліну та сфінгомієліну в неактивній стадії хронічного ПН у дітей, які проживають в УКI, порівняно з показниками дітей групи контролю.
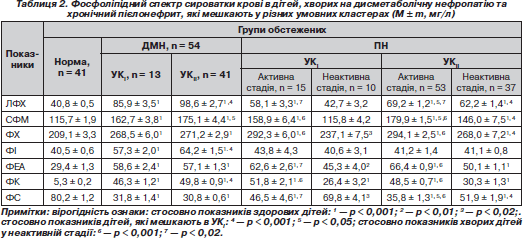
У хворих на ДМН, які мешкають в УКII, вірогідно підвищений уміст лізофосфатидилхоліну, сфінгомієліну, фосфатидилінозиту та фосфатидної кислоти порівняно з хворими, які мешкають в УКI.
Кількісний уміст лізофосфатидилхоліну, сфінгомієліну та фосфатидилсерину в сироватці крові вірогідно (р < 0,05) відрізняється у хворих на хронічний ПН, які мешкають в УКII, незалежно від стадії, порівняно з хворими, які мешкають в УКI. Також у дітей, які проживають в УКI, збільшений рівень фосфатидилхоліну в неактивній стадії порівняно з хворими, які мешкають в УКII, у тій же стадії захворювання. Уміст усіх фракцій фосфоліпідного обміну, за винятком рівня фосфатидилінозиту, значно більше змінено в активній стадії хронічного ПН порівняно з показниками дітей у неактивній стадії захворювання, незалежно від місця мешкання, що підтверджує вплив активності запального процесу в організмі на стабільність клітинних мембран.
Змін із боку інших показників фосфоліпідного обміну виявлено не було, що, напевно, обумовлено їх здатністю до взаємоперетворення та швидкістю пластичних процесів дитячого організму.
При вивченні фосфоліпідного складу крові в дітей із різними варіантами ураження нирок, які мешкають у різних умовних кластерах, відзначають вірогідне підвищення в сироватці крові усіх фракцій фосфоліпідів та зниження вмісту фосфатидилсерину порівняно з показниками дітей групи контролю (табл. 3).
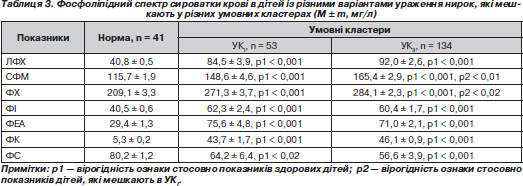
Як видно з табл. 3, виявлено значне підвищення кількісного вмісту сфінгомієліну та фосфатидилхоліну в дітей, які мешкають в УКIІ, порівняно з показниками дітей, які проживають в УКI.
Змін концентрації інших фракцій фосфоліпідів у хворих, які мешкають в обох кластерах, виявлено не було.
Таким чином, отримані дані можуть характеризувати більш виражені мембранодеструктивні процеси у дітей, які мешкають в УКII, порівняно з хворими, які мешкають в УКІ, що дає підставу для припущення щодо розвитку екодетермінованої патології нирок.
Висновки
За результатами проведеного дослідження виявлені зміни у фосфоліпідному складі крові в дітей із різними варіантами ураження нирок, які мешкають у різних умовах екологічного благополуччя, дають підставу припустити, що в генезі цих змін можуть мати місце тубулярні порушення як фактор активності та тяжкості запального процесу. Окрім того, отримані нами дані свідчать, що на зміни рівнів показників дестабілізації клітинних мембран впливають не тільки активність запалення, залучення тубулоінтерстиціальної тканини в патологічний процес, але й дія несприятливих екологічних факторів зовнішнього середовища.
1. Неділько В.П. Шляхи удосконалення медичної допомоги дітям України // Актуальні проблеми сучасної охорони здоров’я України. — К., 2007. — С. 38-41.
2. Schieppati A., Mosconi L., Perna A. Prognosis of untreated patients with idiopathic membranous nephropathy // N. Engl. J. Med. — 2002. — Vol. 329. — P. 85-89.
3. Коренев Н.М., Немирова О.А., Булага Л.П. Состояние здоровья подростков Украины // Проблеми мед. науки та освіти. — 2005. — № 4. — С. 5-7.
4. Лук’янова О.М. Проблеми здоров’я здорової дитини та наукові аспекти профілактики його порушень // Мистецтво лікування. — 2005. — № 2. — С. 6-15.
5. Нагорна Н.В., Дубова Г.В. Екологія та патологія органів дихання у дітей: медико-соціальні аспекти // Здоровье ребенка. — 2009.— № 4(19). — С. 14-18.
6. Осадчук З.В. Стан здоров’я дітей, які проживають у різних за екологічною характеристикою регіонах України // Перинатологія та педіатрія. — 2000. — № 2. — С. 25-27.
7. Каблукова О.К., Горовий І.С., Антонець Т.І. та ін. Роль фосфоліпідів та b2-мікроглобуліну в хронізаціїї гломерулонефриту у дітей // Педіатрія, акушерство та гінекологія. — 2007. — № 4. — С. 107.
8. Клиническая биохимия / А.Я. Цыганенко, В.И. Жуков, В.В. Мясоедов и др. — М.: Триада-Х, 2002. — 504 с.
9. Комов В.П., Шведова В.Н. Биохимия. — М.: Дрофа, 2008. — 638 с.
10. Камышников В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике. — М.: Медпресс-информ, 2004. –— 911 с.
11. Гублер Е.В. Вычислительные методы диагностики. — Л.: Медицина, 1987. — 97 с.
12. Зосимов А.М., Голік В.П. Дисертаційні помилки (медицина). — Харків: Торнадо, 2003. — 199 с.
