Журнал «Здоровье ребенка» 2 (23) 2010
Вернуться к номеру
Оксидативный стресс: влияние на организм человека, методы оценки
Авторы: Нагорная Н.В., Четверик Н.А., Донецкий национальный медицинский университет им. М. Горького
Рубрики: Педиатрия/Неонатология
Версия для печати
В статье представлены сведения о значении оксидативного стресса в жизнедеятельности организма, его особенностях при различных патологических процессах, методах оценки, наиболее достоверным из которых является определение уровней малонового диальдегида и восстановленного глутатиона в плазме крови. Выявление оксидативного стресса в организме важно уже на ранних, иногда доклинических, стадиях различных заболеваний, при оценке степени тяжести патологического процесса, для контроля эффективности профилактических и лечебно-реабилитационных мероприятий.
Оксидативный стресс, норма, патология, методы оценки.
Около 95 % поступающего в организм кислорода в процессе окислительного фосфорилирования восстанавливается в митохондриях до воды. Остальные 5 % в результате различных (как правило, ферментативных) реакций преобразуются в его активные формы, являющиеся высокотоксичными для клеток [22, 23].
Активные формы кислорода (АФК) — свободные радикалы, прооксиданты — представляют собой молекулярные частицы, имеющие непарный электрон на внешней орбите и обладающие высокой реакционной способностью, которая заключается в повреждении белков, нуклеиновых кислот и липидов биологических мембран клеток [1, 3, 14, 15, 19]. В норме в здоровом организме образование АФК происходит непрерывно. Сведения об основных активных формах кислорода и других прооксидантах, присутствующих в живых организмах, представлены в табл. 1.
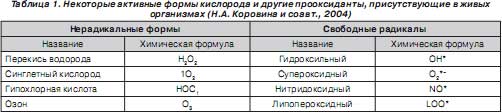
Доказано, что АФК и другие прооксиданты участвуют в механизмах бактерицидности, в синтезе биологически активных веществ, в обмене коллагена, регуляции проницаемости мембран и др. [1]. Формирование свободных радикалов — важный защитный механизм, лежащий в основе неспецифического иммунитета: фагоцитоз приводит к многократному увеличению содержания свободных радикалов в фагоцитирующих клетках с одновременным повышением потребления кислорода в 20 и более раз (так называемый «дыхательный взрыв») [4]. Вместе с тем АФК являются основой патогенеза многих патологических процессов, обладают антигенными свойствами, запускают аутоиммунные процессы повреждения тканей, вызывают бронхоконстрикцию и т.д. [1, 4].
Следует отметить, что существование человека в условиях современной техногенной цивилизации, нарушение веками складывавшихся между людьми и природой отношений неизбежно приводят к постоянному появлению стрессовых ситуаций, их накоплению и в конечном счете к развитию патологических изменений в различных органах и системах [26]. Негативное влияние факторов окружающей среды (табачный дым, загрязнение воздуха выбросами транспорта и промышленных предприятий, радиационное и ультрафиолетовое излучение, ксенобиотики, в том числе лекарства, анестетики, пестициды, промышленные растворители и др.), чрезмерная физическая нагрузка, стресс, переутомление сопровождаются увеличением образования свободных радикалов.
Нарушение обмена веществ и энергии, накопление активных повреждающих агентов (свободных радикалов, прооксидантов, АФК), инициирующих повреждение клеток и ведущих к развитию различных патологических состояний, получило название оксидативного стресса [3, 4, 23, 26]. Его основу составляет свободнорадикальное окисление жирных кислот, или так называемое перекисное окисление липидов (ПОЛ).
Внимание к проблемам повреждения клеток при различных заболеваниях, в том числе сердечно-сосудистых, в отечественной кардиологии и терапии было значительным уже начиная с 20–30-х гг. XX века благодаря работам Г.Ф. Ланга [2]. Однако до недавнего времени биологи не предполагали, что свободные радикалы могут возникать и гибнуть при биохимических процессах в организме человека и животного. Когда в 1969 году Joe M. McCord and Irwin Fridovich заявили, что супероксидный анион, опасный свободный радикал, формируется в живом организме, а такой энзим, как супероксиддисмутаза, позволяет его обезвредить, их коллеги в научно-исследовательских институтах всего мира отнеслись к таким выводам с нескрываемым скептицизмом [24]. Огромный вклад в понимание процессов свободнорадикального окисления внес известный исследователь биохимик Richard Passwater. Его пионерная работа о возможности замедления процессов старения появилась в печати в 1971 году, когда термины «свободный радикал» и «антиоксидантная терапия» были знакомы только очень узкому кругу профессионалов. Спустя 2 года R. Passwater опубликовал данные своих последующих исследований, из результатов которых впервые стало известно о существовании связи между свободными радикалами и онкологической патологией [25]. В 1977 году им была опубликована фундаментальная работа, посвященная свободным радикалам [26].
В западных странах интерес к оксидативному стрессу значительно возрос в связи с результатами работ E. Braunwald (1982) о «гибернации миокарда» (hibernatio — зимняя спячка). Этот термин был заимствован из зоологии и использован для отражения состояния дисфункции и гипоперфузии миокарда, потенциально способного к восстановлению при улучшении перфузии [1, 27, 28]. Доказано, что снижение температуры тела больного всего на 1 °С уменьшало интенсивность обмена в нем на 5–6 %. Из этого следовало, что, понизив температуру тела больного на 20 °С, можно добиться снижения обмена в 100 (!) раз [29]. С того времени увеличилось число исследований о состоянии энергопродуцирующих процессов в живом организме.
В настоящее время доказано, что процесс ПОЛ начинается с реакции инициирования цепи, вследствие которой образуются супероксидный и гидроксильный радикалы [2, 3, 13, 26]. Если такой радикал образуется вблизи клеточной мембраны, он имеет тенденцию реагировать с полиненасыщенными жирными кислотами (ПНЖК) боковых цепей липидов с образованием свободного радикала углерода в мембране. Последний, реагируя с молекулярным кислородом, образует пероксильный радикал (LOO*).
В случае отсутствия соответствующего антиоксиданта пероксид липида «извлекает» водород из другой ближайшей ПНЖК с образованием гидропероксида (LOOH) и нового углеродного радикала. Эта реакция начинает новый этап свободнорадикального цепного процесса, когда гидроперекиси разлагаются, инициируя новые цепи. Не все радикалы продолжают цепь, часть их взаимодействует друг с другом, образуются неактивные продукты, что приводит к обрыву цепи. Помимо спонтанного обрыва цепей прерывание возможно при взаимодействии с Fe 2+ , а также при взаимодействии с антиоксидантами [1, 3, 14, 15, 19].
В результате самоускоряющейся реакции свободнорадикального окисления образуется множество продуктов ПОЛ, к которым относятся:
— гидроперекиси липидов (первичные продукты ПОЛ) — неустойчивые вещества, которые легко подвергаются дальнейшим превращениям с образованием целого ряда более устойчивых вторичных продуктов окисления: альдегидов, кетонов, ряда низкомолекулярных кислот (муравьиной, уксусной, масляной). Эти вещества являются токсичными для клетки, приводят к нарушению функций мембран и метаболизма в целом;
— диеновые конъюгаты — образуются путем отрыва атома водорода от молекулы ПНЖК, чаще арахидоновой (липоперекиси с сопряженными двойными связями);
— перекисные радикалы — Н*, *ОН, НО 2 *;
— малоновый диальдегид — образуется в процессе окислительной деструкции липидов, входит в состав вторичных продуктов ПОЛ;
— шиффовы основания — конъюгированные соединения, образующиеся из ПНЖК, диальдегидов и других вторичных продуктов ПОЛ [1, 3, 14, 15, 19].
Для оценки интенсивности ПОЛ наиболее часто используют количественное определение малонового диальдегида (МДА) [1, 3, 5–10, 17]. Его повышение является методом раннего выявления метаболических нарушений в организме, даже на доклинической стадии заболевания [11, 17, 18, 20].
В противовес свободнорадикальным процессам в организме существует антиоксидантная система (АОС), представляющая собой совокупность защитных механизмов клеток, тканей, органов и систем, направленных на сохранение и поддержание гомеостаза в организме [1, 3, 4, 21]. Равновесие между этими двумя противоположными составляющими в состоянии физиологического оптимума удерживает перекисное окисление на определенном низком уровне, препятствуя развитию цепного окислительного процесса и характеризует антиоксидантный статус организма [1, 3]. Без его универсальной эндогенной системы защиты нормальное существование организмов в биосфере Земли в условиях загрязненной атмосферы, естественного радиационного фона и ультрафиолетового излучения Солнца было бы невозможным [1].
Различают ферментативные и неферментативные составляющие АОС. Ферментативное звено представлено глутатионпероксидазой, супероксиддисмутазой и каталазой. Они имеют определенную специализацию по отношению к конкретным видам радикалов и перекисей [1, 3, 5, 11, 13]. Согласно имеющимся данным [17], активность глутатионпероксидазы уже на ранних стадиях сосудистой патологии головного мозга уменьшена почти вдвое по сравнению со здоровыми и имеет тенденцию к дальнейшему уменьшению по мере прогрессирования заболевания.
Неферментативное звено АОС состоит из соединений низкомолекулярной и белковой природы (табл. 2).

Витамин Е (токоферол) среди жирорастворимых антиоксидантных мембранопротекторов играет важнейшую роль, обладая способностью повышать уровень природных липидных антиоксидантов. Он взаимодействует с гидроксильным радикалом (*ОН), оказывает «погашающее» действие на синглетный кислород, инактивирует супероксидный радикал и ингибирует липидные радикалы, защищает от токсического действия озона, блокируя порождаемые им радикальные реакции [1, 3–5, 15, 16, 18].
Единственным липидорастворимым антиоксидантом, который синтезируется в клетках и постоянно регенерируется из окисленной формы, является убихинон. Его роль как важнейшего переносчика электронов в дыхательной цепи предопределяет улучшение прогноза при различной патологии:
— сердечно-сосудистой системы (ишемическая болезнь сердца, атеросклероз и его осложнения, артериальная гипертензия) [2, 3, 12–14, 18, 21];
— при анемиях (стимулирует процесс кроветворения) [1, 3, 11, 20];
— при гипоиммунных состояниях, повышая фагоцитарную активность макрофагов, число гранулоцитов в костном мозге и плазме крови, увеличивая количество иммуноглобулинов, поддерживая функцию вилочковой железы [1, 3, 4];
— в профилактике и лечении астенического синдрома и синдрома хронической усталости [1, 4, 6];
— при хронической интоксикации (выводит из организма свободные радикалы и радионуклеиды) [1, 11];
— используется в комплексных программах лечения гипоксических состояний любого происхождения [1, 4, 11, 12, 18].
Антиоксидантная функция витамина А — защита любых биологических мембран от повреждения активными формами кислорода [1, 3, 4, 12, 21].
Аскорбиновая кислота (витамин С) является наиболее важным антиоксидантом межклеточной жидкости, не синтезируется и не имеет депо в организме человека; связывает и инактивирует АФК (О 2 *, *ОН) и органические пероксиды; защищает липопротеины низкой плотности и другие липиды от окислительного повреждения, захватывая свободные радикалы до того, как они достигают мембраны; восстанавливает окисленную форму витамина Е; играет ведущую роль в антиоксидантной защите головного мозга [1, 3, 4, 12, 21].
Глутатион выполняет функцию донора водорода и кофактора ряда антиоксидантных ферментных систем. Снижение внутриклеточного содержания восстановленного глутатиона, обусловленное генетической недостаточностью ферментов его синтеза или введением антагонистов, существенно снижает устойчивость клеток и организма к лучевому поражению или интоксикации. Глутатион содержится внутри клеток. На долю глутатиона приходится 90–95 % всех небелковых тиоловых соединений. Наиболее богаты глутатионом ткани печени и мозга. Функции глутатиона в организме разнообразны: защита от активных форм кислорода, восстановление дисульфидных связей, влияние на активность многочисленных ферментов, поддержание оптимального состояния биомембран, реализация коферментных функций, участие в обмене эйкозаноидов, функционирование в качестве резерва цистеина, участие в биосинтезе нуклеиновых кислот, участие в метаболизме ксенобиотиков, повышение клеточной резистентности к токсикантам и другим вредным воздействиям, стимуляция пролиферации [1, 3–5, 11, 12, 14–16, 21].
Заслуживает внимания еще одна группа антиоксидантов — биофлавоноиды. Они снижают артериальное давление, пропульсивную активность мускулатуры кишечника, устраняют бронхоспазм, оказывают укрепляющее действие на капилляры. Одним из наиболее известных представителей этой группы является витамин Р (рутин) [1, 3, 4].
В антиоксидантной защите жидких сред организма играют важную роль также серосодержащая аминокислота таурин, мочевина, мочевая кислота, билирубин, полиамины. Мочевина содержится в жидких средах организма, препятствуя образованию метгемоглобина. Эффективно защищает центральную нервную систему, легкие и кровь от окислительного стресса.
Мочевая кислота также ингибирует ПОЛ и восстанавливает метгемоглобин с образованием малоактивного радикала урата. Защищает клетки крови, частично связана с белками и высвобождается в стрессовых ситуациях [1, 3, 4].
Церулоплазмин — многофункциональный медьсодержащий белок сыворотки крови (α2-глобулиновой фракции), является гликопротеином. Синтезируется в гепатоцитах и, являясь главным внеклеточным антиоксидантом крови, ингибирует ПОЛ до 50 % за счет перехвата и инактивации супероксидного радикала (О 2 *). Действуя как антиоксидант, оказывает мощное противовоспалительное действие. Он осуществляет транспорт меди, доставляя ее в ткани для синтеза цитохром-С-оксидазы и других ферментов, участвует в регуляции биогенных аминов и регуляции их функций, является стимулятором кроветворения и регулятором функций крови [1, 3, 4].
Особое значение имеют изменения в антиоксидантном статусе детей. Это связано с незрелостью физиологических и метаболических систем детского организма и легко возникающих вследствие этого нарушений под влиянием различных неблагоприятных факторов внешней среды [1, 3, 4, 6–8, 11].
Болезни, относящиеся к классу свободнорадикальной патологии, широко распространены, в том числе и в детском возрасте, начиная с периода новорожденности (бронхолегочная дисплазия, ретинопатия недоношенных, некротический энтероколит и др.) [1, 7, 8, 19]. Ослабление антиоксидантной защиты и неконтролируемое усиление процессов перекисного окисления липидов является одним из важных звеньев патогенеза вегетативной дисфункции, атопического дерматита, стоматологической патологии, сахарного диабета, артропатий, заболеваний желудочно-кишечного тракта, мочевыводящих путей и др. [1, 6, 9, 10]. При этом в крови и тканях достигают высоких концентраций продукты перекисного окисления липидов, в частности малоновый альдегид, дестабилизирующий клеточные мембраны [1, 3, 4].
К настоящему времени накопилось большое количество данных, свидетельствующих об участии свободнорадикальных процессов в патогенезе ряда инфекционных болезней [1].
Доказано усиление процессов ПОЛ в ишемизированном миокарде, при атеросклерозе, артериальной гипертензии, мозговой гипоперфузии и др. [1, 4, 5, 7, 17, 21].
Известно, что интенсивность процессов ПОЛ зависит от степени выраженности воспалительного процесса [13], в связи с этим эффективность лечения во многом обусловлена степенью защиты клеточных мембран. Вот почему практически при любой патологии обоснованно включение в комплексную терапию антиоксидантных препаратов. Однако не следует забывать и о том, что некоторые продукты питания являются источниками природных антиоксидантов, а следовательно, обладают вышеперечисленными эффектами [1, 3, 4]. Основные источники природных антиоксидантов представлены в табл. 3.

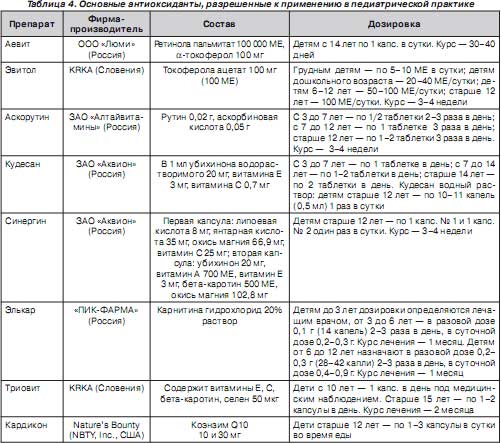
В настоящее время выпускается значительное количество препаратов, обладающих антиоксидантными свойствами, ряд из которых представлен в табл. 4. Включение их в комплекс терапии помогает повысить эффективность лечебно-реабилитационных и профилактических программ на всех этапах медицинской помощи детям (поликлиники, стационары, санатории, реабилитационные центры).
Результаты исследования состояния перекисных и антиоксидантных процессов, проведенного нами в 2008 году у 50 детей 12–18 лет (27 мальчиков и 23 девочки), проживающих в экологически неблагоприятных условиях Донбасса, свидетельствовали о наличии оксидативного стресса и дисбаланса антиоксидантной системы у 100 % обследованных. Проведение этим детям 30-дневного курса Нейровитана привело к улучшению самочувствия и положительным изменениям, заключавшимся в снижении уровня лактатацидоза (различной степени) у всех обследованных, нормализации оксидативного баланса у 54,0 ± 7,0 % учащихся [30]. Указанное свидетельствует о наличии антиоксидантной активности препарата Нейровитан («Хикма Фармасьютикалз»).
Таким образом, изучение показателей оксидативного стресса, развивающегося в результате дисбаланса между оксидантной и антиоксидантной системами, помогает раскрыть патогенез многих патологических процессов, оценить степень риска их возникновения, прогнозировать особенности течения заболевания. Устранение оксидативного стресса помогает повысить эффективность профилактических и лечебно-реабилитационных мероприятий.
Приведенные материалы убеждают нас в необходимости более широкого использования антиоксидантов в комплексной терапии острых и хронических заболеваний у детей наряду с другими патогенетическими методами лечения. Их выбор должен определяться характером патологического процесса и степенью его активности.
1. Коровина Н.А., Захарова И.Н., Обыночная Е.Г. Применение антиоксидантов в педиатрической практике // http: media consilium/03_09/ Feb — 2004.
2. Лещинский Л.Д. Обоснование и опыт применения ряда ингибиторов перекисного окисления липидов у больных ишемической болезнью сердца // ТОП-Медицина. — 1998. — № 4. — С. 17-21.
3. Суханова Г.А., Серебров В.Ю. Биохимия клетки. — Томск: Чародей, 2000. — С. 91-142.
4. Курашвили В.А., Майлэм Л. Новые возможности предотвращения оксидативного стресса // Журнал натуральной медицины. — 2001. — № 1. — С. 7-14.
5. Щербаков А.Е. Исследование показателей перекисного окисления липидов и антиоксидантной системы в комплексе мероприятий вторичной профилактики инсультов // http: www.rusmedserv.com/2000
6. Литвин Б.С. Вплив комплексної медикаментозної терапії на окисний гомеостаз у дітей з вегетативними дисфункціями // Педіатрія, акушерство та гінекологія. — 2007. — № 2. — С. 16-18.
7. Васильева Е.М., Баканов М.И., Поддубная А.Е., Шор Т.А. Перекисное окисление липидов при неврологической патологии у детей // Клиническая лабораторная диагностика. — 2005. — № 2. — С. 8-12.
8. Арефьева И.А., Демчук М.Л., Артарян А.А., Мирсадов Д.А. и др. Исследование процессов свободнорадикального окисления липидов в ликворе детей с гидроцефалией // Вопросы медицинской химии. — 1999. —№ 4.
9. Олійник Я.В. Порушення перекисного окислення ліпідів та їх корекція у дітей, хворих на атопічний дерматит // Вісник наукових досліджень. — 2007. — № 3. — С. 39-42.
10. Новожилова Г.П., Аксенова В.М., Мозговая Л.А. Состояние перекисного окисления липидов и антиоксидантной системы в плазме, эритроцитах и слюне детей с патологией органов полости рта, отягощенной дисбиозом кишечника // http: www.stomatburg.ru/articles/klin
11. Барабой В.А., Сутковой Д.А. Окислительно-антиоксидантный гомеостаз в норме и патологии / Под. ред. акад. АМН Украины Ю.А. Зозули. — К.: Чернобыльинтеринформ, 1997. — Ч. 1, 2.
12. Овсянникова Л., Носач Е. Антиоксидантные препараты: проблема выбора // Doctor. — 2003. — № 1. — С. 74-76.
13. Казимирко В.К., Мальцев В.И. Aнтиоксидантная система и ее функционирование в организме человека // http: www.health-ua.com /2004
14. Esterbauer H., Gebicki J., Puhl H., Jurgens G. The role of lipid peroxidation and antioxidants in oxidative modification of LDL // Free Radic. Biol. Med. — 1992. — № 13. — P. 341-390.
15. Frei B., Stocker R., Ames B.N. Antioxidant defenses and lipid peroxidation in human blood plasma // Proc. Natl. Acad. Sci. USA. — 1988. — № 85. — Р. 9748-9752.
16. Krinsky N.L. Membrane antioxidants // Ann. NY. Acad. Sci. — 1988. — № 551. — Р. 17-33.
17. Яворская В.А, Малахов В.А., Белоус А.М. Интенсивность процессов перекисного окисления липидов и активность антиоксидантных ферментов в эритроцитах при начальных формах сосудистых заболеваний головного мозга // Неврологический вестник. — 1995. — Т. XXVII, вып. 3–4. — С. 15-17.
18. Halliwell B.O., Gutteridge J.M.C. Free radicals in biology and medicine. — Oxford: Clarendon Press, 1989.
19. Поздняков А.А. Ранняя диагностика гипоксического поражения ЦНС у новорожденных // http://www.vsma.ac.ru/publ/vest/011/09.doc
20. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. — М., 1993. — Т. 1–2. — 779 с.
21. Зозуля Ю.А., Барабой В.А., Сутковой Д.А. Свободнорадикальное окисление и антиоксидантная защита при патологии головного мозга. — М.: Знание-М., 2000. — 9 с.
22. Кашкалда Д.А., Бориско Г.А. Окислительно-антиоксидантный гомеостаз у подростков, рожденных в семьях ликвидаторов последствий аварий на ЧАЭС // Современная педиатрия. — 2008. — № 3. — С. 11-14.
23. Julie K. Andersen. Oxidative stress in neurodegeneration: cause or consequence? // Nature Reviews Neuroscience. — 2004. — 5. — 18-25.
24. Joe M. McCord and Irwin Fridovich. Superoxide Dismutase an enzimic function for erythrocurrein (hemocuprein) // The Journal of Biological Chemistry. — 1969. — 244. — 6049-6055.
25. Passwater R. Selenium and other antioxidants in reducing cancer incidence // Cancer: New Direction. American Laboratory. — 1973. — 67. — 37-45.
26. Курашвили В.А. Купирование оксидативного стресса с помощью натуральных антиоксидантов // http://vitadoctor.com.ua
27. Braunwald E., Kloner R. The stunned myocardium: prolonged, postischemic ventricular dysfunction // Circulation. — 1982. — 66. — 1146-1149.
28. Vanoverschelde J.L., Wijns W., Depre C. et al. Mechanisms of chronic regional postischemic dysfunction in humans. New insights from the study of noninfarcted collateral-dependent myocardium // Circulation. — 1993. — 87. — 1513-1523.
29. Петракович Г. Естественный и искусственный гипобиоз у человека // http://www.glubinnaya.info
30. Нагорная Н.В., Четверик Н.А., Дубовая А.В., Федорова А.А., Муравская И.Ю. Оксидативный стресс у детей, проживающих в экологически неблагоприятных условиях. Возможности нейровитана в его коррекции // Современная педиатрия. — № 1(23). — 2009. — С. 124-129.
